 研发追踪
研发追踪
 医药魔方
医药魔方
 2023.06.19
2023.06.19
 1800
1800
AKT,也称为磷酸激酶B (PKB),在涉及细胞生长和分裂、细胞凋亡抑制和血管生成的多种级联信号传导机制中发挥着关键作用。
对于处于PI3K/AKT/mTOR关键信号通路中心节点的AKT而言,如若发生PTEN缺失、AKT/PIK3CA突变或扩增等都会引起AKT信号通路的过度激活诱发肿瘤的发生和发展。相关研究也表明AKT激活与肿瘤治疗中的耐药性相关。AKT由此也成为了肿瘤治疗的热门靶标。
纵览AKT药物的开发历程,最早介入AKT抑制剂探索和临床开发的公司是葛兰素史克、默沙东、礼来、拜耳,阿斯利康、罗氏(基因泰克)等一众巨头。不过虽然系出名门,但是这些公司开发的AKT抑制剂或者出售,或者研发终止,如礼来的LY2780301、拜耳的BAY1125976等,在一定程度上也说明了新药研发的不确定性以及AKT信号通路的巨大复杂性和挑战性。默沙东的MK-2206,在进行了40多项早期试验后也最终折戟沉沙。
6月12日,阿斯利康宣布FDA已受理该公司first-in-class AKT抑制剂capivasertib联合Faslodex(氟维司群)的新药申请(NDA)同时被授予了优先审评资格,用于治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。FDA将在2023年第四季度做出审评决定。这也意味着AKT靶点在经历了40多年的艰难探索后终于迎来曙光。

该项NDA也正在接受Orbis项目的审查,该项目是FDA的一项倡议,旨在为参与的国际合作伙伴之间同时提交和审查肿瘤药物提供框架,以加快药物在全球的审批。Capivasertib是三种AKT亚型(AKT1/2/3)的高效选择性抑制剂。AKT信号通路的激活,包括PIK3CA、AKT1和PTEN的改变,可出现在许多HR+/HER2-的晚期乳腺癌患者中,但也可能出现在没有这些基因改变的患者中。AKT信号通路与内分泌治疗耐药的发生有关。该项NDA是基于一项代号为CAPItello-291的III期试验数据,该研究结果已于最近在线发表于《新英格兰医学杂志》上。CAPItello-291研究是一项全球、多中心、双盲、随机的III期临床试验,共纳入708例患者,旨在评估capivasertib+氟维司群对比安慰剂+氟维司群治疗HR+/HER2-晚期乳腺癌患者的疗效和安全性,这些患者在接受AI治疗期间或之后疾病复发或进展。研究允许患者既往接受过CDK4/6抑制剂治疗(至少51%),但既往未接受过SERD、mTOR抑制剂、PI3K抑制剂或AKT抑制剂。

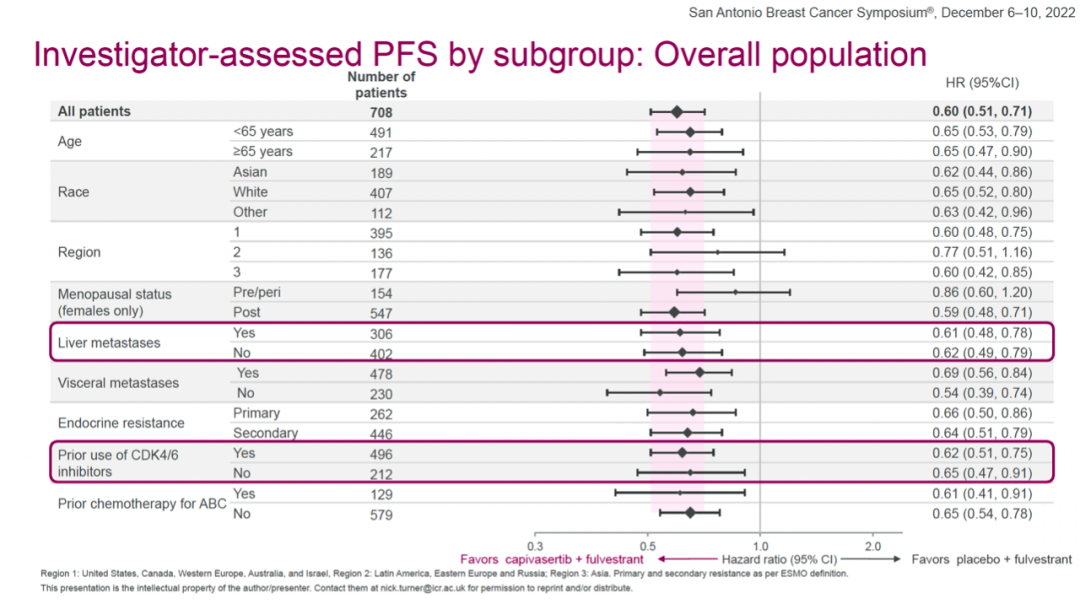
主要终点方面,在全体人群中,capivasertib+氟维司群组和安慰剂+氟维司群组的中位PFS分别为7.2个月和3.6个月,capivasertib+氟维司群将疾病进展或死亡风险降低了40%(HR=0.60(0.51-0.71,two-sided P<0.001)。
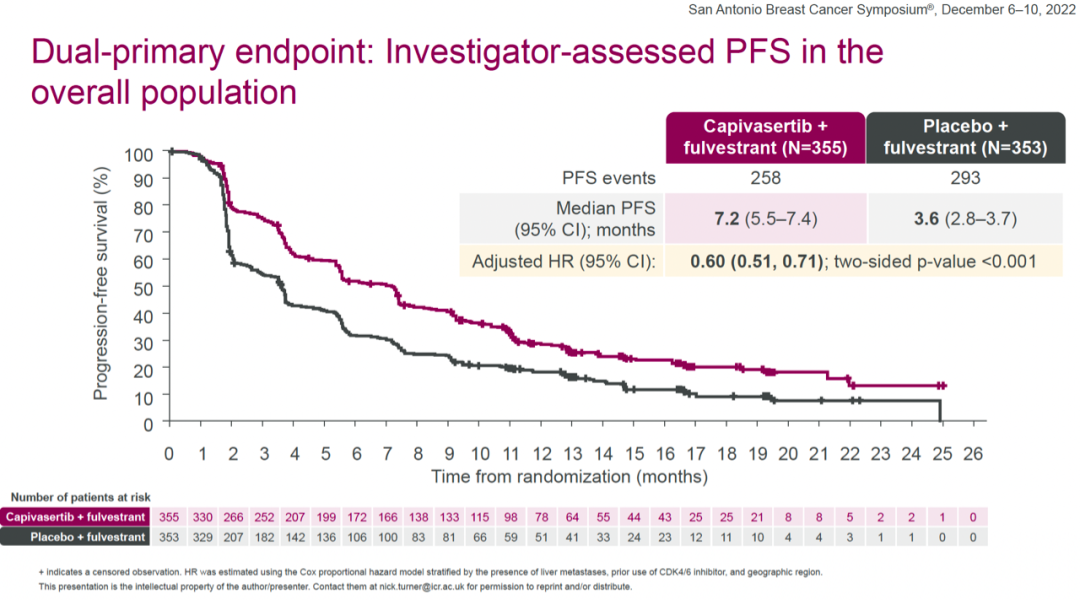
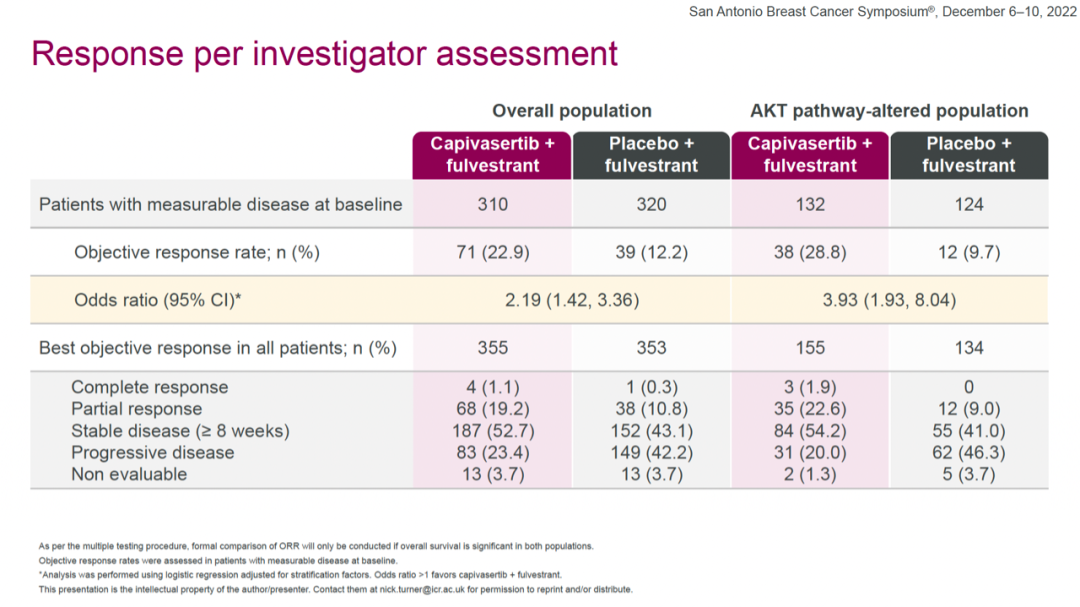
在AKT通路改变人群中,capivasertib+氟维司群组和安慰剂+氟维司群组的中位PFS分别为7.3个月和3.1个月,HR=0.50(0.38-0.65,two-sided P<0.001)。
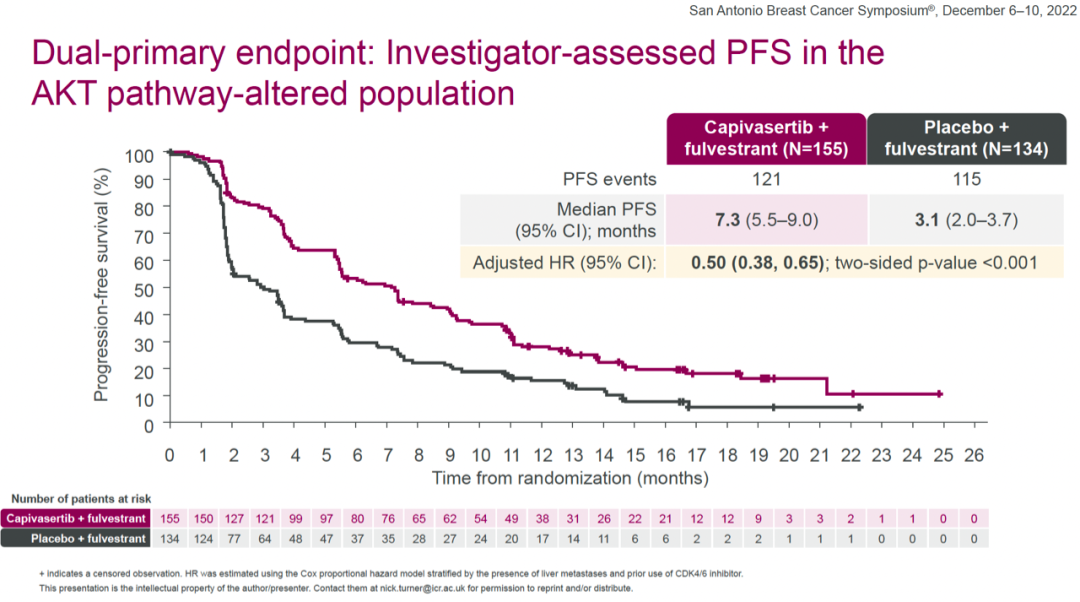
探索性分析显示,在AKT通路未改变人群中(包括状态未知),两组的中位PFS分别为7.2个月和3.7个月,HR=0.70(0.56-0.88)。
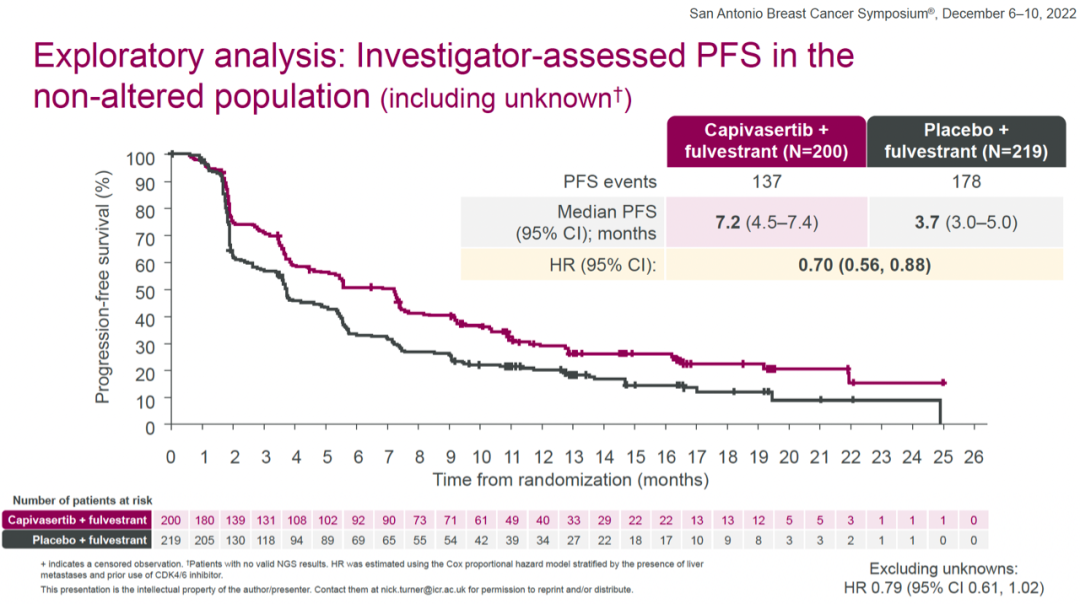
不论是否存在肝转移或既往接受过CDK4/6抑制剂治疗,capivasertib+氟维司群组的HR均有优势。
ORR方面,全体人群中capivasertib+氟维司群组和安慰剂+氟维司群组的ORR分别为22.9%和12.2%;AKT通路改变人群中,两组的ORR分别为28.8%和9.7%,OS数据尚未成熟(28%的总体成熟度)。
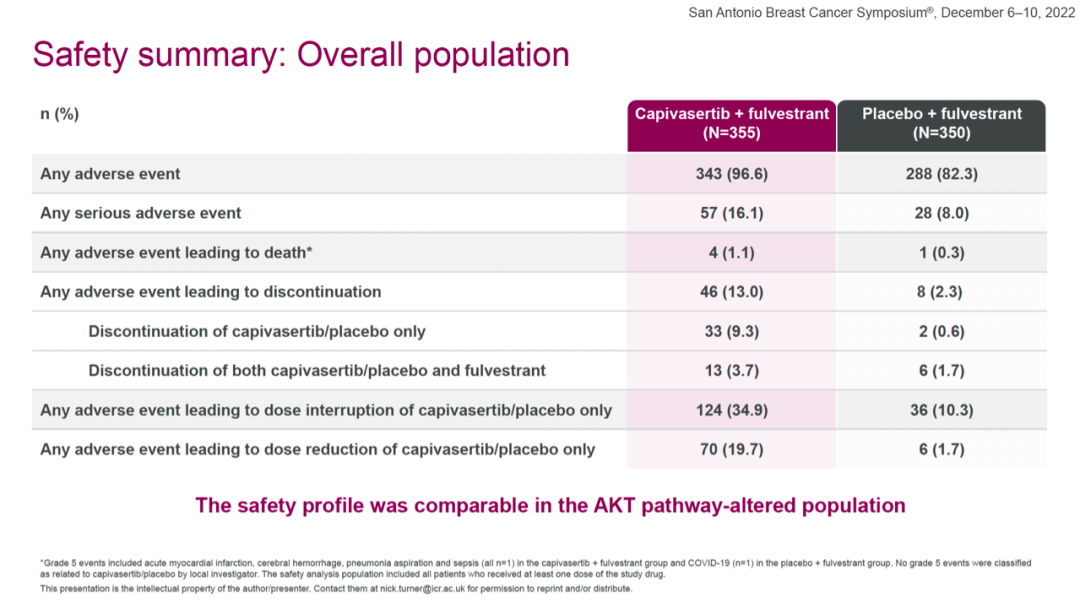
安全性方面,总体人群中,capivasertib+氟维司群组和安慰剂+氟维司群组出现任何不良事件的比例分别为96.6%和82.3%;任何严重不良事件的比例分别为16.1%和8.0%;任何不良事件导致治疗中止的比例分别为13.0%和2.3%。常见不良反应包括腹泻、恶心、皮疹、疲劳、呕吐、头痛等。
乳腺癌是全球最常见的癌症,估计每年有230万患者确诊。预计2023年美国将有超过29万名患者确诊,超过4.3万人死亡。超过65%的乳腺癌肿瘤被认为是HR阳性和HER2低表达或阴性。内分泌疗法广泛用于HR阳性乳腺癌的治疗,但许多晚期疾病患者对一线CDK4/6抑制剂和内分泌疗法产生耐药性,需要其他的治疗选择。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34649
34649

 医谷
医谷
 2019.03.18
2019.03.18
 18942
18942

 医药地理
医药地理
 2018.10.22
2018.10.22
 18924
18924