 研发追踪
研发追踪
 药明康德
药明康德
 2023.08.21
2023.08.21
 1609
1609
今日,顶尖科学期刊《科学》上发表的一项重磅研究中,Revolution Medicines公司和纪念斯隆-凯瑟琳癌症中心的科学团队展示了使用小分子药物靶向“不可成药”靶点的新策略。同期发布的评论文章指出,这种结合结构生物学、理性设计和医药化学的设计方法,与高通量筛选相结合,有望更快开发分子胶疗法,靶向多种“不可成药”靶点。

KRAS蛋白曾经是著名的“不可成药”靶点,它的表面光滑,没有明显可供小分子药物结合的“口袋”。不过,科学家发现KRAS G12C突变体的半胱氨酸可以被共价小分子药物靶向,这一突破最终带来了FDA批准的两款KRAS抑制剂sotorasib和adagrasib。不过这些抑制剂均靶向KRAS G12C突变体的失活状态,而且患者可能接受治疗后产生耐药性。
在这项研究中,科学家们试图开发针对激活状态的KRAS G12C突变体的抑制剂。他们将注意力放在一个名为CYPA的分子伴侣蛋白上,CYPA最初作为免疫抑制药物环孢菌素A(cyclosporin A)的受体被发现。它与环孢菌素A结合之后,能够与钙调磷酸酶(calcineurin)形成复合体并抑制磷酸酶活性。有趣的是,CYPA或环孢菌素A并不能独自与钙调磷酸酶结合。这一作用揭示了分子胶的作用机制——小分子药物可以将两个原本没有相互作用的蛋白拉到一起来产生活性。
基于这一发现,研究团队尝试对与CYPA结合的天然产物进行改造,让它们能够介导CYPA与激活状态下的KRAS G12C突变体结合。经过多轮基于结构的化合物优化,研究人员发现了名为RMC-4998的候选分子胶化合物。它能够与CYPA和激活状态下的KRAS G12C突变体构成三元复合体。而且,与KRAS G12C结合的CYPA会阻断激活的KRAS突变体与下游效应蛋白产生相互作用,从而抑制促进细胞增殖的信号传导。
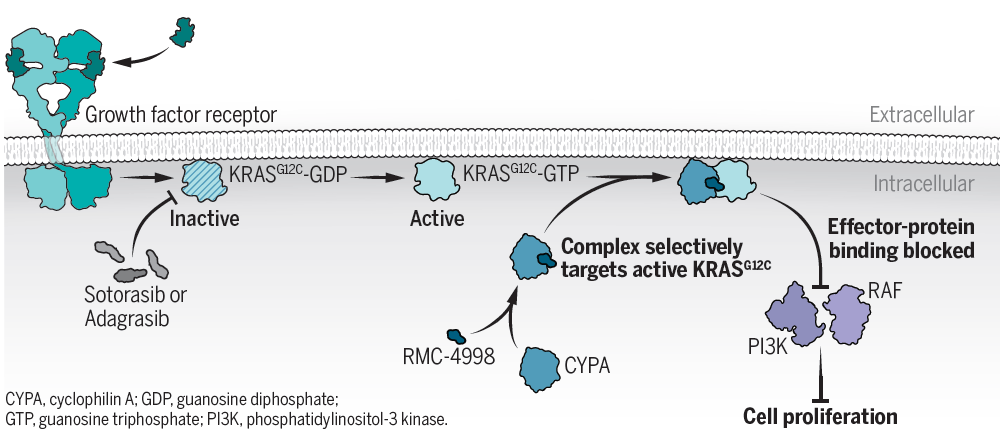
▲针对失活状态的KRAS G12C的抑制剂和针对激活状态的KRAS G12C的分子胶的作用机制(图片来源:参考资料[2])
在细胞培养研究中,RMC-4998和基于这款化合物开发的激活态KRAS G12C分子胶抑制剂RMC-6291表现出强有力的抗癌活性。而且在非小细胞肺癌和结直肠癌的小鼠移植模型中,RMC-6291导致多种肿瘤的体积显著缩小。
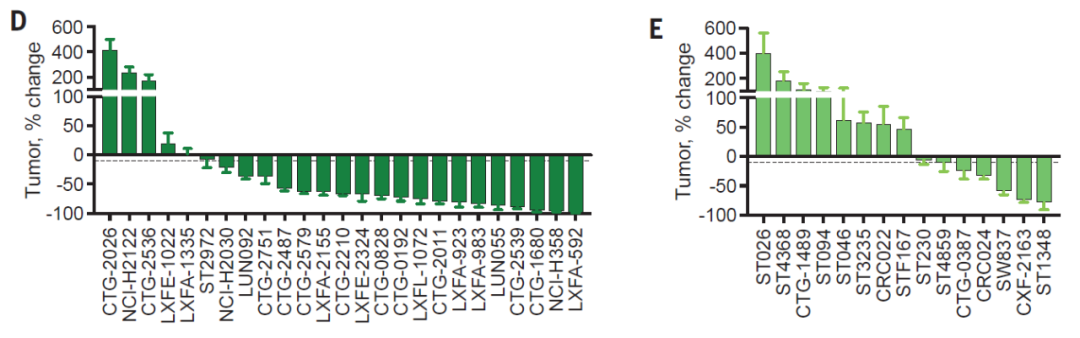
▲RMC-6291在非小细胞肺癌(D)和结直肠癌(E)的动物模型中表现出强力抗癌活性(图片来源:参考资料[1])
论文作者指出,CYPA与激活状态下KRAS G12C突变体结合的界面包含了多个氨基酸之间的相互作用。这种作用机制让分子胶药物能以更高的选择性靶向抑制KRAS G12C的活性。而且,由分子胶介导的相互作用更不容易因为KRAS G12C或CYPA蛋白上出现的基因突变而受到抑制。这意味着针对RMC-4998和RMC-6291的耐药性突变更难产生,因此它们在临床应用中可能表现出更持久的疗效。目前,RMC-6291已经开展1/1b期临床试验,在携带KRAS G12C突变体的实体瘤患者中评估其安全性并进行剂量优化,最初的研究将聚焦于非小细胞肺癌患者,并可能包括结直肠癌患者。
同期发布的评论文章表示,CYPA蛋白作为分子伴侣蛋白已经被发现可以通过与分子胶结合,分别与钙调磷酸酶和KRAS G12C突变体形成复合体,而且与钙调磷酸酶或KRAS G12C突变体结合的相互作用界面并不相同。这意味着这类分子伴侣蛋白本身具有很强的可塑性,在不同分子胶的诱导下,它们可以形成不同的相互作用界面,与多种蛋白类型结合。这揭示了一条使用CYPA靶向其它“不可成药”靶点的分子胶开发策略。
最后,这项研究的分子胶开发方式是基于与CYPA蛋白结合的天然产物,通过多轮基于结构的化学优化最终制造出候选分子。这一开发方式可以与其它基于高通量筛选的分子胶开发方式相辅相成,进一步加快创新分子胶的发现和开发。它们的应用不局限于KRAS,可用于靶向其它小GTPase、G蛋白,以及其它类型的“不可成药”靶点。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34557
34557

 医谷
医谷
 2019.03.18
2019.03.18
 18904
18904

 医药地理
医药地理
 2018.10.22
2018.10.22
 18897
18897