 研发追踪
研发追踪
 药明康德
药明康德
 2023.10.30
2023.10.30
 1602
1602
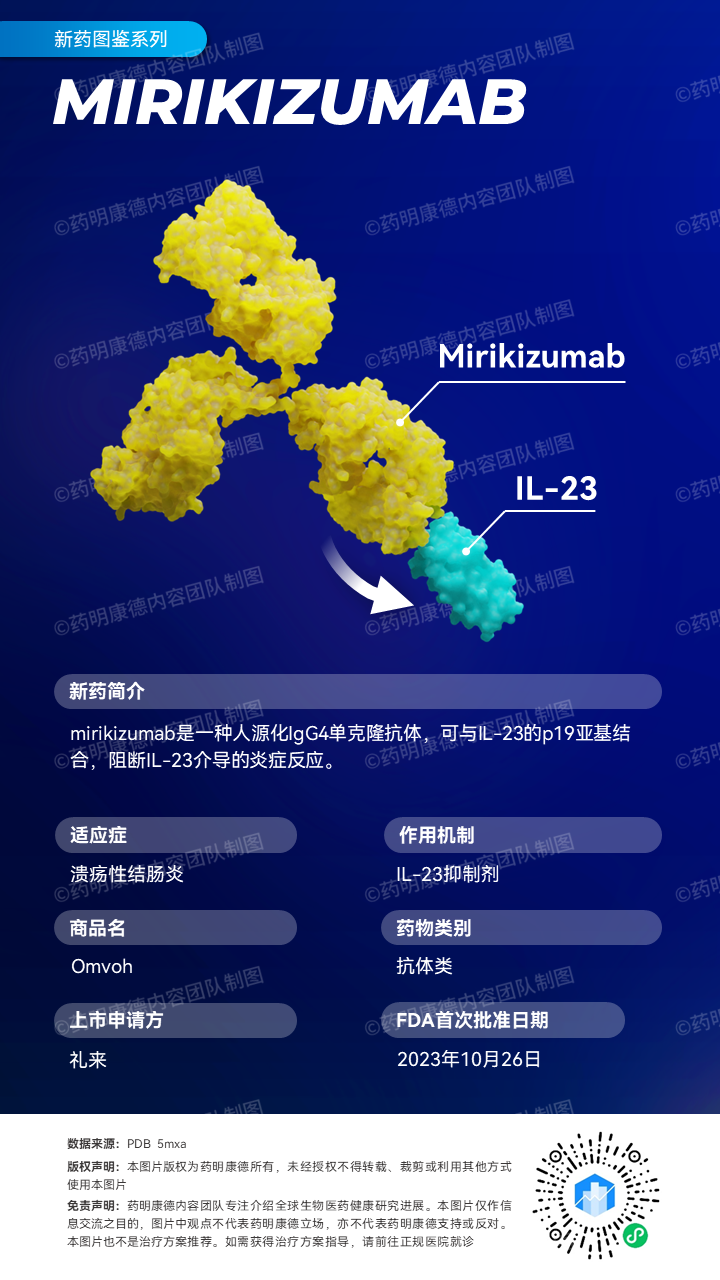
礼来(Eli Lilly and Company)今天宣布,美国FDA已批准Omvoh(mirikizumab)上市,用于治疗中重度活动性溃疡性结肠炎(UC)成人患者。新闻稿指出,这是首个用于治疗这一患者群体的IL-23p19拮抗剂。
UC是一种大肠慢性炎症引起的疾病。它引发腹痛、血性腹泻、严重的排便紧迫感、体重减轻和疲乏。症状的严重程度和疾病复发的不确定性给患者造成了沉重的负担,并经常导致残疾。全球有上百万人受到UC的困扰。
礼来公司开发的mirikizumab是一种人源化IgG4单克隆抗体,可与IL-23的p19亚基结合,阻断IL-23介导的炎症反应。
FDA的批准是基于LUCENT临床项目的结果,该项目包括两项随机双盲、含安慰剂对照的3期临床试验,包括一项为期12周的诱导治疗研究(UC-1)和一项为期40周的维持治疗研究(UC-2)。LUCENT项目中的所有患者既往均接受过治疗,包括生物制品治疗,但未产生疗效、疗效丧失或无法耐受。
试验结果显示,Omvoh治疗12周后,65%的患者获得临床应答(clinical response),24%的患者获得临床缓解(clinical remission)。安慰剂组的临床应答和临床缓解率分别为43%和15%。在12周达到临床缓解的患者中,66%的患者在连续治疗1年期间维持临床缓解,安慰剂组这一数值为40%。根据事后分析,几乎所有(99%)在1年时达到临床缓解的患者在52周评估结束前至少3个月不使用类固醇。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34382
34382

 医药地理
医药地理
 2018.10.22
2018.10.22
 18838
18838

 医谷
医谷
 2019.03.18
2019.03.18
 18797
18797