 研发追踪
研发追踪
 药研网
药研网
 2023.10.30
2023.10.30
 1684
1684
10月26日,ImmunityBio宣布FDA已接受其重新提交的N-803 BLA审查,PDUFA 日期设定为 2024 年 4 月 23 日。

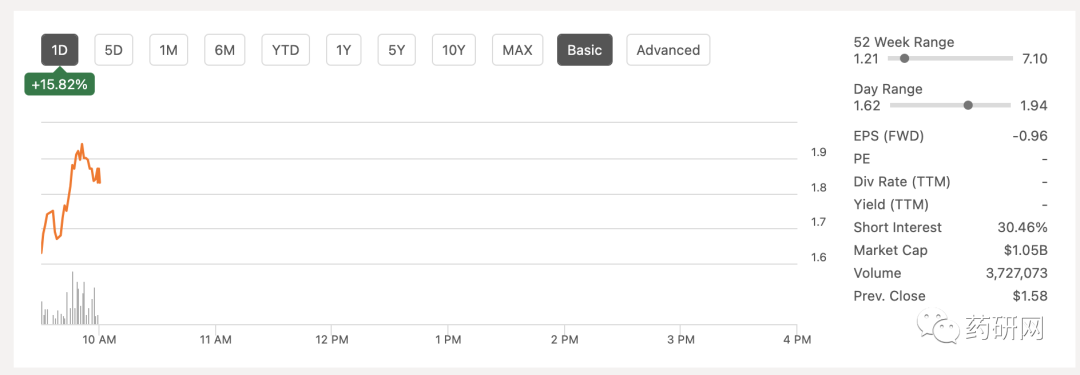
受此消息影响,ImmunityBio股价上涨。

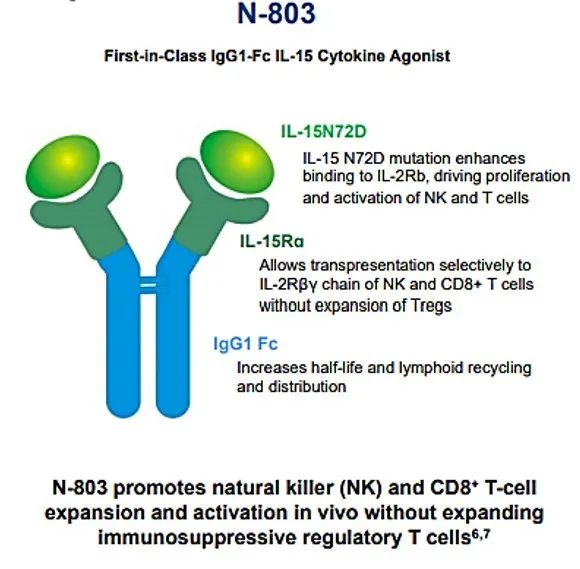
N-803是一种IL-15超级激动剂,与卡介苗(BCG)联合用于治疗对卡介苗无反应的非肌层浸润性膀胱癌原位癌(CIS)。
N-803由 IL-15 突变体(IL-15N72D)与 IL-15 受体 α/IgG1 Fc 融合蛋白结合而成。它的作用机制是通过与βγ T 细胞受体结合直接特异性刺激 CD8+ T 细胞和 NK 细胞,生成记忆 T 细胞,同时避免刺激调节性T细胞。与原生、非络合 IL-15 相比,N-803 的药代动力学特性得到改善,在淋巴组织中的持久性更长,体内抗肿瘤活性更强。
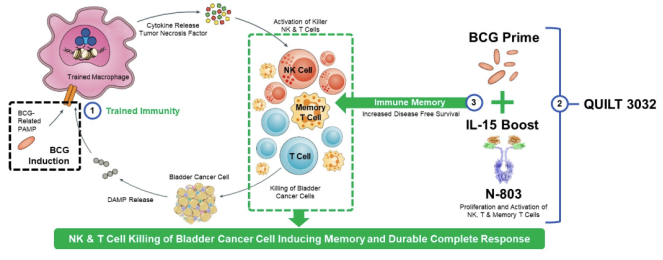
此次上市申请主要基于一项II/III期研究(QUILT 3.032),并对FDA确定的响应者做了反应持续时间的更新。更新结果表明,应答受试者的缓解持续时间延长,中位CR持续时间尚未达到,应答者的随访时间超过28个月,安全性与之前的报告相同。这些卡介苗无应答受试者的最新CR持续时间显示,CR维持时间≥24个月的概率为60%,≥24个月时无膀胱切除率超过90%。此外,ImmunityBio公司还提供了1b期(QUILT-2.005)试验中接受N-803联合卡介苗治疗CIS±Ta/T1的受试者长期随访(QUILT-205)的最新情况,检查了2014年以来进入试验的9名受试者的生存情况。所有9名受试者(100%)都获得了完全缓解。在这9名受试者中,2人因膀胱癌以外的原因死亡,1人失去随访机会。在可进行随访的 6 名受试者(QUILT-205)中,6 名受试者(100%)在 8.8 年的中位生存期内实现了长期完全缓解并保留了膀胱,迄今为止,所有 6 名受试者都避免了膀胱切除术。
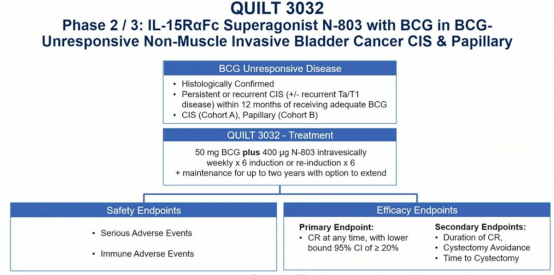
ImmunityBio曾于去年5月提交上市申请,但今年5月因第三方合同制造商存在缺陷被FDA拒绝。此前公布的数据如下:QUILT 3.032是一项II/III期、开放标签、单臂、多中心的研究,对卡介苗不响应的NMIBC患者进行膀胱内灌注卡介苗加N-803或只注射N-803。
患者分为两组。A组是原位癌,B组是乳头状肿瘤。
毒副作用结果显示,几乎没有出现全身性的副作用。
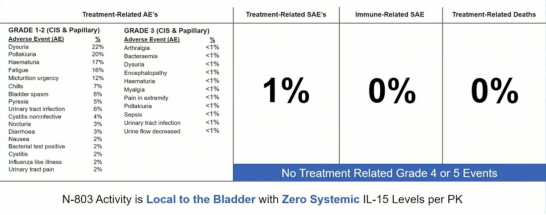
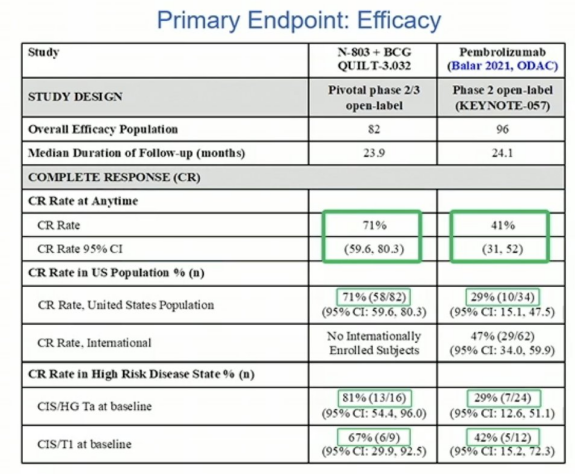
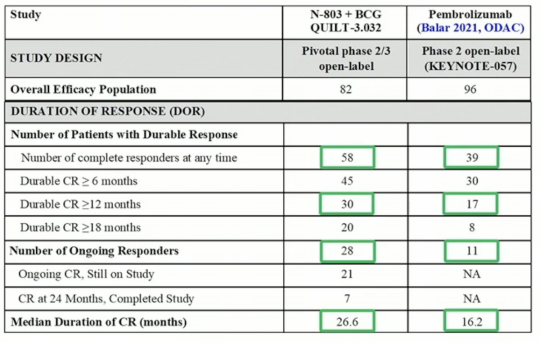
A组结果,卡介苗加N-803的CR为71%,反应的中位时间超过两年。只有16%的患者进行了膀胱切除术,100%的患者在数据截止时被诊断为膀胱癌,但仍然活着。
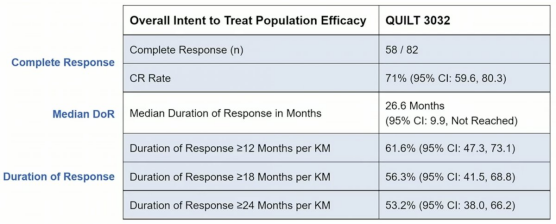
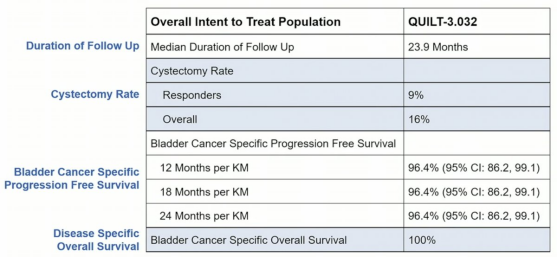
生存曲线图如下:
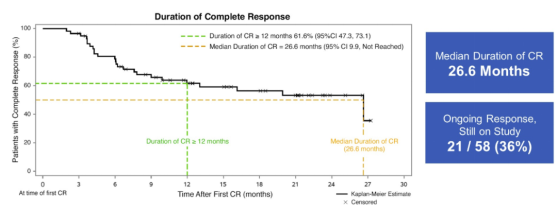
A组结果与KEYNOTE-057 的结果进行比较(非头对头):
B组结果如下:12个月DFS为55%
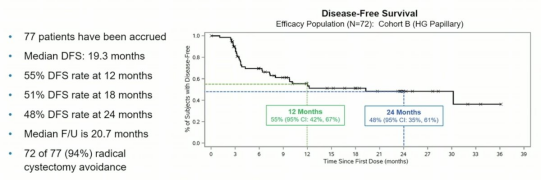
总结:

A (CIS +/- papillary tumors)

B (Papillary tumors)

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34395
34395

 医药地理
医药地理
 2018.10.22
2018.10.22
 18844
18844

 医谷
医谷
 2019.03.18
2019.03.18
 18802
18802