 研发追踪
研发追踪
 药明康德
药明康德
 2023.11.06
2023.11.06
 1587
1587
X4 Pharmaceuticals宣布,美国FDA已正式接受他们为12岁及以上WHIM综合症患者递交的每日一次口服mavorixafor的新药申请(NDA)。FDA并授予mavorixafor申请优先审评资格,并设定处方药用户费用法案(PDUFA)日期为2024年4月30日。根据新闻稿,若获批,mavorixafor将有可能成为WHIM综合征患者的首个疗法。
Mavorixafor是一种在研创新的小分子拮抗剂,靶向CXCR4受体。它是专为WHIM综合症和某些类型的慢性中性粒细胞减少症制定的每日一次口服疗法。Mavorixafor在获得FDA授予突破性疗法认定、快速通道资格、孤儿药资格以及罕见儿科疾病认定(RPD)。
此NDA的递交得到了4WHIM全球3期关键临床试验的支持。这项试验评估每日一次口服mavorixafor在WHIM综合症患者中的疗效和安全性。结果令人鼓舞,4WHIM试验达主要终点与关键次要终点,即药物组患者体内中性粒细胞与淋巴细胞的绝对数量维持在具临床意义阈值之上的时间,明显优于安慰剂组患者(p<0.0001)。
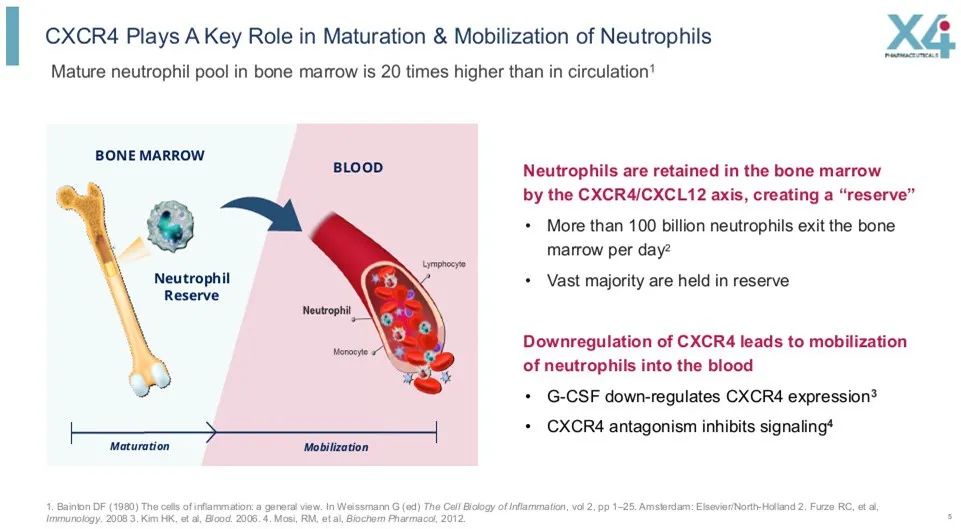
▲CXCR4拮抗剂药理机制(图片来源:参考资料[2])
此外,药物在试验中显示了可靠的安全性,没有报告与治疗相关的严重不良事件或因安全问题而中断。重要的是,试验数据还显示,与安慰剂相比,接受mavorixafor治疗患者感染的频率、严重性和持续时间均有所减少。
参考资料:
[1] X4 Pharmaceuticals Announces FDA Acceptance withPriority Review of U.S. NDA for Mavorixafor in WHIM Syndrome. Retrieved October31, 2023 from https://investors.x4pharma.com/news-releases/news-release-details/x4-pharmaceuticals-announces-fda-acceptance-priority-review-us
[2] Current Corporate Presentation. Retrieved October 31, 2023from https://investors.x4pharma.com/static-files/eae36b57-f69f-4fba-ad24-eb1012be88b2

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34390
34390

 医药地理
医药地理
 2018.10.22
2018.10.22
 18842
18842

 医谷
医谷
 2019.03.18
2019.03.18
 18800
18800