 研发追踪
研发追踪
 凯莱英药闻
凯莱英药闻
 2023.12.04
2023.12.04
 1551
1551
2023年11月27日,专注于严重罕见病和癌症的生物制药公司SpringWorks Therapeutics宣布,美国食品和药物管理局(FDA)已批准其口服γ分泌酶抑制剂OGSIVEO™(nirogacestat)用于需要全身治疗的进展性硬纤维瘤成人患者。
此前,FDA曾授予 nirogacestat 治疗硬纤维瘤的突破性疗法、快速通道和孤儿药称号。此外,SpringWorks预计将于2024年上半年向欧洲药品管理局提交OGSIVEO上市许可申请。
硬纤维瘤是一种局部侵袭性和浸润性软组织肿瘤,可导致严重的发病率,严重可危及生命,且手术切除后的复发率高77%。
关于DeFi试验结果
FDA批准 OGSIVEO 主要依据3期DeFi 试验结果,该结果发表在 2023 年 3 月 9 日出版的《新英格兰医学杂志》 上。
DeFi(硬纤维瘤病/纤维瘤病)试验是一项 3 期临床试验,旨在评估一种名为 nirogacestat 的研究药物在 18 岁以上患有进展性硬纤维瘤的人群中的安全性、有效性和耐受性,根据试验结果:
1、OGSIVEO达到了改善无进展生存期 (PFS) 的主要终点,与安慰剂相比有显著的统计学改善,疾病进展风险降低了 71%(危险比 (HR) = 0.29 (95% CI: 0.15, 0.55);P< 0.001)。
2、OGSIVEO治疗组未达到中位生存期,安慰剂治疗组的中位生存期为15.1个月。根据RECIST v1.1标准确认的客观反应率(ORR),OGSIVEO为41%,安慰剂为8%(P<0.001);OGSIVEO治疗组的完全反应率为7%,安慰剂为0%。
3、无论基线特征如何,包括性别、肿瘤位置、肿瘤病灶、治疗状态、既往治疗、突变状态和家族性腺瘤性息肉病史,OGSIVEO 的 PFS 和 ORR 均有改善。
4、OGSIVEO还显示出患者报告结果(PROs)的早期和持续改善,包括疼痛(p<0.001)、类脂样肿瘤特异性症状(p<0.001)、身体/角色功能(p<0.001)和总体健康相关生活质量(p≤0.01)。
5、在接受OGSIVEO治疗的患者中,最常见的不良事件(>15%)是腹泻、卵巢毒性、皮疹、恶心、疲劳、口腔炎、头痛、腹痛、咳嗽、脱发、上呼吸道感染和呼吸困难。OGSIVEO 具有可控的安全性和耐受性。
关于OGSIVEO™
OGSIVEO™是一种口服、选择性小分子γ分泌酶抑制剂,γ 分泌酶可切割多种跨膜蛋白,包括 Notch,这些蛋白被认为在激活有助于 生长的途径中发挥作用 硬纤维瘤和卵巢颗粒细胞瘤。
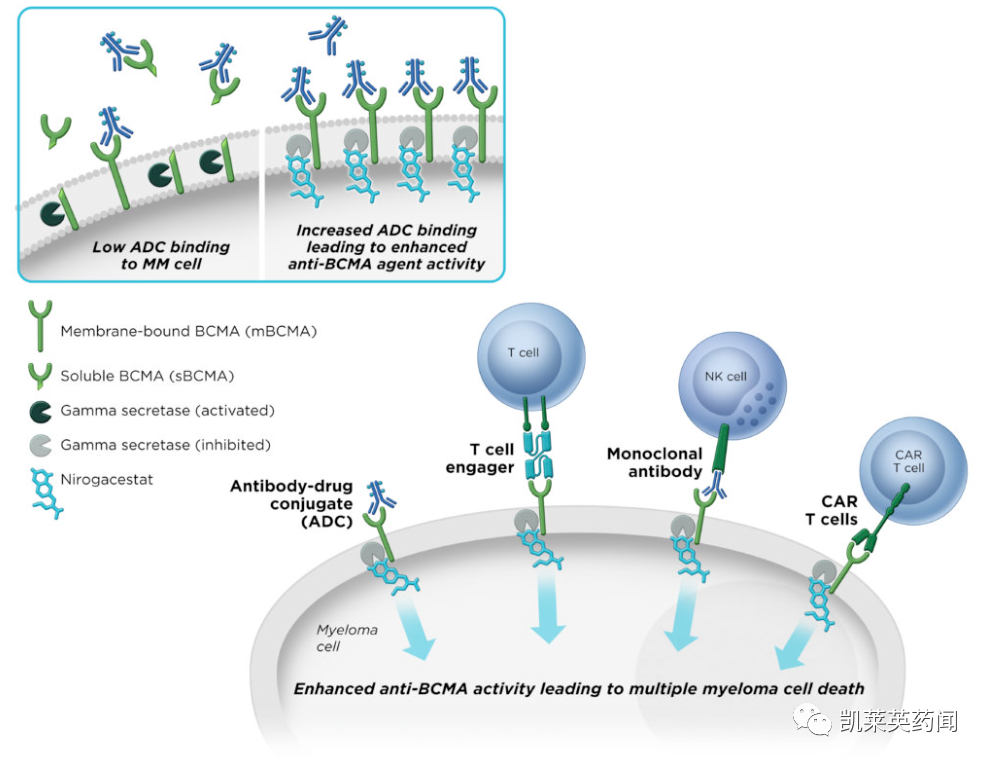
已证明γ 分泌酶可以切割 BCMA,BCMA 是一种在多发性骨髓瘤细胞上特异性表达的治疗靶标。SpringWorks认为,通过用nirogacestat抑制γ分泌酶,膜结合的BCMA可以保留在骨髓瘤细胞表面,从而增加靶密度,同时降低可溶性BCMA的水平,这可能会干扰BCMA靶向治疗的活性。nirogacestat与BCMA靶向治疗联合使用可能会增加其活性并改善多发性骨髓瘤患者的预后。
因此除硬纤维瘤以外,SpringWorks 还在与业界和学术界的领先企业合作,评估将nirogacestat 作为卵巢颗粒细胞瘤患者和多发性骨髓瘤患者的潜在治疗药物,作为几种B细胞成熟抗原(BCMA)联合治疗方案的一部分。
关于 SpringWorks
SpringWorks成立于 2017 年,是一家处于商业化阶段的生物制药公司,采用精准医疗方法为严重罕见病和癌症患者开发和提供改变生命的药物。拥有多元化的肿瘤靶向药物管线,涵盖实体瘤和血液肿瘤,包括罕见肿瘤类型和高发、基因定义癌症的临床试验。成立至今与强生、辉瑞、GSK、艾伯维、百济神州等跨国药企达成合作。OGSIVEO™是SpringWorks首个获得FDA批准的疗法。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34442
34442

 医药地理
医药地理
 2018.10.22
2018.10.22
 18857
18857

 医谷
医谷
 2019.03.18
2019.03.18
 18831
18831