 研发追踪
研发追踪
 星耀研究院
星耀研究院
 2023.12.11
2023.12.11
 1915
1915
2023年12月7日/医麦客--星耀研究院新闻 PharmaBIGStar News/--近日,TCR-T细胞疗法先驱企业Adaptimmune宣布,已经向美国FDA完成其TCR-T细胞疗法Afami-cel的生物制品许可申请(BLA)的滚动式递交过程,用于治疗晚期滑膜肉瘤。Afami-cel符合优先审查资格,这将缩短FDA对申请的审查时间至8个月,
Afami-cel是一款MAGE-A4靶向的TCR-T细胞疗法,MAGE-A4作为癌睾丸抗原,在多种肿瘤组织中高表达,该产品也是全球首款申报上市的TCR-T细胞疗法。FDA已授予其治疗晚期软组织肉瘤的孤儿药资格(ODD)和晚期滑膜肉瘤的再生医学高级疗法(RMAT)资格。
本次申报上市基于关键试验SPEARHEAD-1的队列1的阳性数据,SPEARHEAD-1是一项针对晚期滑膜肉瘤或粘液样/圆形细胞脂肪肉瘤(MRCLS)患者的2期开放标签试验,旨在评估TCR-T产品afami-cel的疗效、安全性和耐受性。
根据Adaptimmune于2022结缔组织肿瘤学会(CTOS)年会上公布的SPEARHEAD-1中队列1的最终分析数据。截至2022年8月29日,52例患者(44例滑膜肉瘤,8例MRCLS)接受了afami-cel治疗,ORR为36.5%(其中滑膜肉瘤为38.6%,MRCLS为25.0%),疾病控制率为88.4%。滑膜肉瘤的缓解中位持续时间约为12个月。
与先前接受过两次或两次以上治疗的滑膜肉瘤患者的历史中位总生存期(mOS)<12个月相比,SPEARHEAD-1患者的中位总生存期(mOS)约为17个月。
70%对afami-cel有反应的晚期滑膜肉瘤患者在治疗后两年内仍然存活。毒性包括细胞因子释放综合征和可逆的血液毒性,与之前的研究结果一致,表明其安全性在可接受范围之内。另外,该研究的队列2整体缓解率与队列1几乎相同(随访成熟时将报告数据)。为探讨TCR-T疗法发展,2024 IBI EXPO 生物创新药产业大会特设第六届肿瘤免疫细胞治疗技术研讨会,汇聚TCR-T领域行业大咖共同探寻未来的发展方向!
华盛顿大学医学院医学和儿科学教授Brian A. Van Tine博士说:“CTOS 2023上显示的额外数据表明,与一年前相比,接受afami-cel治疗的滑膜肉瘤患者的长期疗效有所提高。该产品有望成为滑膜肉瘤的首创疗法,持这种产品广泛使用的呼声很高。”
国内TCR-T进展迅速
作为一款具有开创性意义的细胞治疗药物,afami-cel的上市之路并不太顺利,该产品因为多种不同因素一次次推迟上市,但是好在历尽千帆,该产品终于走到了商业化前夕。而其每跨越一道障碍,也给后来者提供了宝贵的经验。一旦这种细胞疗法走通了商业化之路,也就意味着整个赛道都将迎来高速发展。
从TIL疗法的国内管线进展来看,国内TCR-T进展迅速。香雪制药、百吉生物、天科雅、普瑞金、深圳宾德、来恩生物、泛恩生物、华夏英泰、立凌生物、可瑞生物等多家药企布局了这一赛道。并且,在半年之内已经有多家企业取得了突破性进展。
据了解,国际著名期刊Cell Reports Medicine刊发了香雪制药的第一款TCR-T细胞药物TAEST16001的1期临床研究成果,该产品适应症为软组织肉瘤,I期临床研究肿瘤客观缓解率(ORR)达到41.7%,中位无进展生存期(PFS)为7.2个月,中位缓解持续时间(DOR)为13.1个月,并已进入II期临床研究。
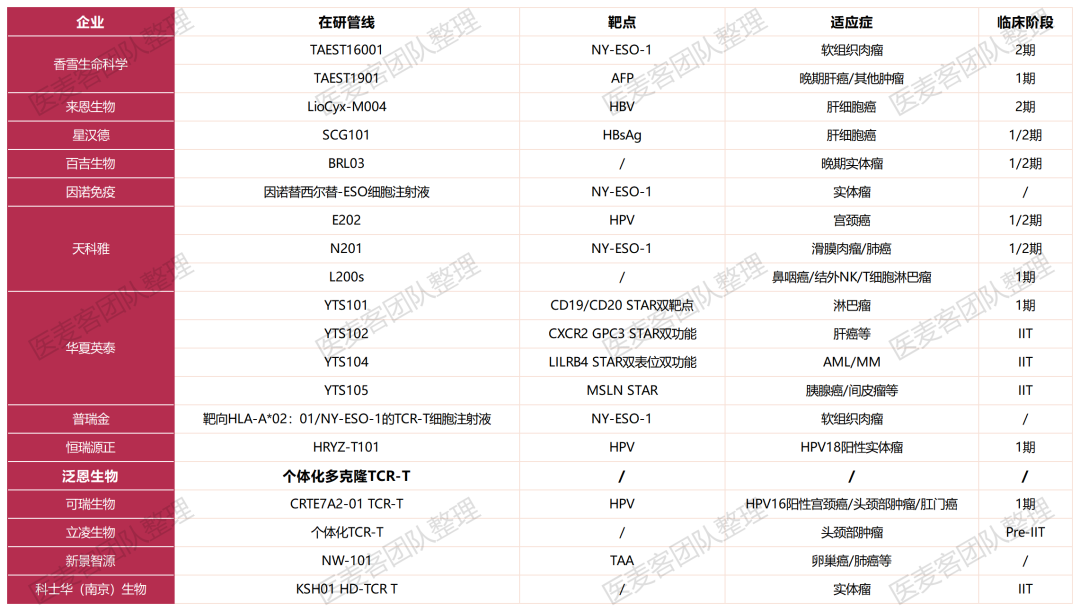
今年5月,基于恒瑞源正自主研发的ReGET平台转化出的首个针对中国人群高频HLA的TCR-T细胞治疗产品HRYZ-T101获批临床,适应症是人乳头瘤病毒18亚型阳性(HPV18)的实体瘤。
今年6月,星汉德生物在国际细胞与基因治疗学会(ISCT)会议上展示了SCG101的最新临床数据:单剂量SCG101输注后可根除100%的HBsAg+肝细胞,使得74.5%的肝肿瘤细胞减少。
2023年的ASCO大会上,天科雅公布了分泌免疫检查点抑制剂的TCR-T细胞治疗EBV阳性鼻咽癌的首次人体1/2期临床试验初步数据:截至2023年1月,2例患者(33.3%)部分缓解(PR),其中1例患者的缓解持续时间长达9个月,3例患者(50%)稳定疾病(SD)。
2023年9月,百吉生物第三条全球首创产品管线BRL03 I/II期临床试验申请获得美国FDA批准,用于治疗多种晚期实体瘤(包括肺癌、胃癌等)。值得一提的是,BRL03还是百吉生物研发的首款进入临床的TCR-T产品,且该产品已经在国内申报临床。
今年11月,可瑞生物首个免疫细胞治疗产品CRTE7A2-01 TCR-T细胞注射液获得临床试验批准通知书,这标志着可瑞生物正式迈向注册临床试验的开展阶段。此外,多家国内企业在这一赛道取得了许多突破性的进展,这也意味着国内TCR-T产业的逐渐成熟。
值得一提的是,跨国巨头在这一领域出现了一定分歧,GSK终止了与Lyell Immunopharm、Adaptimmune、Immatics的细胞疗法合作项目,三项终止的合作均属于TCR-T细胞疗法领域。而阿斯利康于去年11月收购了一家TCR-T疗法企业,以加速在实体瘤TCR-T细胞疗法领域的布局,最高收购金额达到3.2亿美元。在GSK看来,细胞疗法领域如今已经太过拥挤,而扩展到实体肿瘤的前景比最初想象的更具挑战性。总的来看,TCR-T细胞疗法挑战与机遇并存,跨国药企态度出现分歧也会酝酿出一些新的机会,而把握这些机会的关键在于管线创新和差异化。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34443
34443

 医药地理
医药地理
 2018.10.22
2018.10.22
 18857
18857

 医谷
医谷
 2019.03.18
2019.03.18
 18831
18831