 研发追踪
研发追踪
 Insight数据库
Insight数据库
 2024.02.26
2024.02.26
 1171
1171
2 月 20 日,默沙东宣布,FDA 已接受 K 药的补充生物制品许可申请(sBLA)并授予优先审评资格,用于联合标准化疗(卡铂和紫杉醇)治疗原发性晚期或复发性子宫内膜癌患者。PDUFA 日期为 2024 年 6 月 21 日。
K 药有望将成为首个晚期子宫内膜癌(无论 MMR 状态如何)一线免疫疗法。

来自:默沙东官网
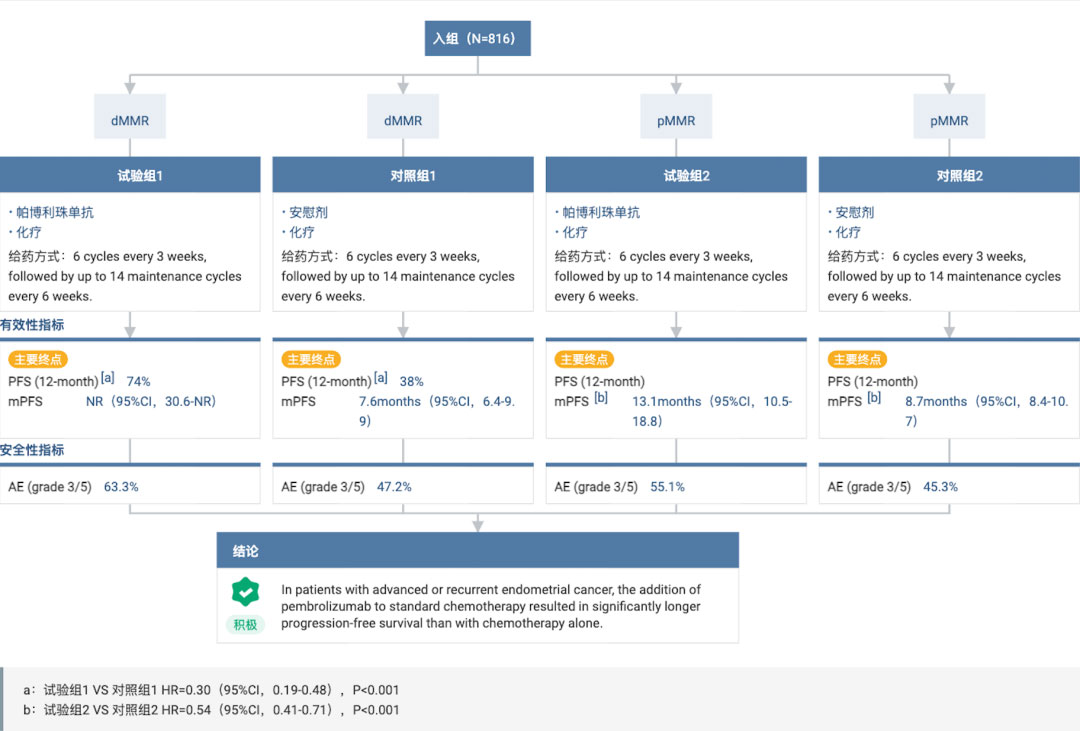
此次 sBLA 主要基于 III 期临床 NRG-GY018 研究结果数据。
NRG-GY018 研究旨在评估 K 药联合化疗对照安慰剂联合化疗在错配修复功能正常(pMMR)型和错配修复缺陷(dMMR)型原发性晚期或复发性子宫内膜癌患者中的疗效和安全性。研究的主要终点为 PFS;次要终点包括安全性、总生存期等。
去年 3 月在 NEJM 期刊上公布的结果数据显示:K 药联合标准化疗相比安慰剂联合标准化疗,可显著降低患者疾病进展或死亡风险 70%(dMMR 队列)和 46%(pMMR 队列)。具体来看:
该研究共有 816 名受试者被纳入研究最终分析,包括 dMMR 队列 225 名,pMMR 队列 591 名。
在 dMMR 队列中,中位随访 12 个月时,K药+化疗组、安慰剂+化疗组的患者中位 PFS 分别为:尚未达到(95%CI:30.6-NR)、7.6 个月(95%CI:6.4-9.9);与安慰剂+化疗相比,K药+化疗可将患者的疾病进展或死亡风险显著降低70%(HR=0.30;95%CI:0.19-0.48;P<0.00001)。
而在 pMMR 队列中,中位随访 7.9 个月,K 药+化疗组、安慰剂+化疗组患者的中位 PFS 分别为 13.1 个月和 8.7 个月;K 药+化疗将患者的疾病进展或死亡风险显著降低了 46%(HR=0.54;95% CI:0.41~0.71;P<0.001)。
安全性方面,K 药与既往临床试验中的安全性一致。在 dMMR 队列中,K 药联合化疗组的不良事件(AE)发生率为 98.2%,3 级及以上 AE 的发生率为 63.3%,而安慰剂联合化疗组则分别为 99.1% 和 47.2%;在 pMMR 队列中,K 药联合化疗组的 AE 发生率为 93.5%(vs 安慰剂联合化疗组为 55.1%),3 级及以上 AE 为93.4%(vs 安慰剂联合化疗组为 45.3%)。
NRG-GY018 研究结果
来自:Insight 数据库网页版
此前 K 药已获 FDA 批准了 2 项针对子宫内膜癌的适应证,分别为:
1)联合仑伐替尼治疗非微卫星高度不稳定(MSI-H)或 pMMR 型晚期子宫内膜癌患者,该类患者既往接受过系统治疗后出现疾病进展且不适合进行根治性手术或放疗;2)单药治疗 MSI-H 或 dMMR 型晚期子宫内膜癌患者,该类患者既往接受过系统治疗后出现疾病进展且不适合进行根治性手术或放疗。
针对子宫内膜癌,据 Insight 数据库显示,默沙东登记启动了 7 项 III 期临床研究,当前仍在积极推进 K 药单药一线疗法(KEYNOTE-C93/ENGOT-en15/GOG-3064)以及联合化疗辅助疗法(KEYNOTE-B21/ENGOT-en11/GOG-3053)等进展。
2023 年 K 药全年销售额已达到 250.11 亿美元,成功问鼎「药王」宝座。当前,除拓展更多癌种外,默沙东还早早的备好更多粮草,已从科伦、第一三共引进多款 ADC 新药,朝着「PD-1 + ADC」联用时代进军。Evaluate Pharma 曾预期 K 药未来峰值销售额有望达到 300 亿美元量级。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34433
34433

 医药地理
医药地理
 2018.10.22
2018.10.22
 18854
18854

 医谷
医谷
 2019.03.18
2019.03.18
 18826
18826