 研发追踪
研发追踪
 医药速览
医药速览
 2024.04.01
2024.04.01
 999
999
2024年3月26日,安斯泰来制药公司宣布,日本厚生劳动省(MHLW)批准claudin 18.2抗体VYLOY™(zolbetuximab)用于治疗CLDN18.2阳性、不可切除、晚期或复发性胃癌患者治疗,VYLOY也是世界上第一个也是唯一获得任何监管机构批准的CLDN18.2靶向疗法。
实际上,Zolbetuximab早在2023年7月就已向FDA提交过BLA,但后来因为生产的问题被拒(今年来FDA抓生产抓得很近,很多药物都都是因为生产问题被拒)。
Zolbetuximab 申报上市获批,主要基于其在 III期 SPOTLIGHT 试验和 GLOW 试验中的不错表现。
SPOTLIGHT试验
SPOTLIGHT试验评估了 Zolbetuximab 联合 mFOLFOX6(经典联合化疗方案,包括奥沙利铂、亚叶酸和氟尿嘧啶)作为一线疗法,对CLDN18.2+、HER2- 的局部晚期不可切除或转移性 G/GEJ 腺癌患者的有效性(Efficacy)和安全性 (Safety)。
结果显示, Zolbetuximab 治疗组 vs 安慰剂组,患者的疾病进展与死亡风险均显著降低 (24.9%),达到了试验的主要终点。
生存期
考虑到患者的治疗基线,在 PFS 和 OS 数据上也有较为显著的提高(~2个月):Zolbetuximab治疗组 VS 安慰剂组的 mPFS: 10.61个月 VS 8.67个月。Zolbetuximab治疗组 VS 安慰剂组的 mOS: 18.23个月 VS 15.54个月。
安全性
两组患者的严重治疗相关不良反应(TRAEs)发生率相似,44.8% vs 43.5%,Zolbetuximab 没有带来严重的额外安全风险。
GLOW试验
GLOW 试验评估了 Zolbetuximab 联合 CAPOX 方案(卡培他滨+奥沙利铂的联合化疗方案)作为一线疗法,对 CLDN18.2+、HER2- 的局部晚期不可切除或转移性胃癌或胃食管交界处腺癌患者的有效性和安全性。
有效性
试验结果显示,Zolbetuximab VS 安慰剂组患者的生存时间有较为显著的提升,中位无进展生存期 (mPFS): 8.21个月 VS 6.8个月;中位生存期(mOS):14.39个月 VS 12.16个月。
此外,两组患者的12个月 PFS 率分别为:35% VS 19%;24个月 PFS 率分别为:14% VS 7%。12个月 OS 率分别为 58% VS 51%,24个月 OS 率分别为 29% VS 17%。
Zolbetuximab 治疗组 VS 安慰剂组的客观缓解率(ORR)分别为 53.8% VS 48.8%;完全缓解率(CR)分别为 3.1% VS 1.5%,部分缓解率(PR):50.8% VS 47.3%,疾病稳定率(SD):23.6% VS 27.8%,疾病进展率(PD)为 5.1% VS 12.2%;中位疾病缓解时间(DOR)分别为 6.28个月 VS 6.18个月。
安全性
Zolbetuximab 组中 98.8%的患者报告了任何级别的治疗相关急性不良反应(TEAEs),而安慰剂组为 98.0%,无显著差异。G3及以上 TEAE 的发生率分别为 72.8% VS 69.9%。
最常见任何级别 TEAE 为 恶心(68.5% vs 50.2%)、呕吐(66.1% vs 30.9%)和食欲下降(41.3% vs 33.7%),Zolbetuximab 组的呕吐发生率有较为显著的增加。
(靶点简介:Claudin-18 splice variant 2;中文名称:密蛋白-18剪接变体2;靶点别称:UNQ778/PRO1572,CLDN18,Claudin 18,Surfactant Associated Protein J,Surfactant, Pulmonary Associated Protein J,Surfactant Associated 5,Claudin-18,SFTA5,SFTPJ,Claudin 18.2,CLDN18.2)
Claudin-18.2临床药物信息
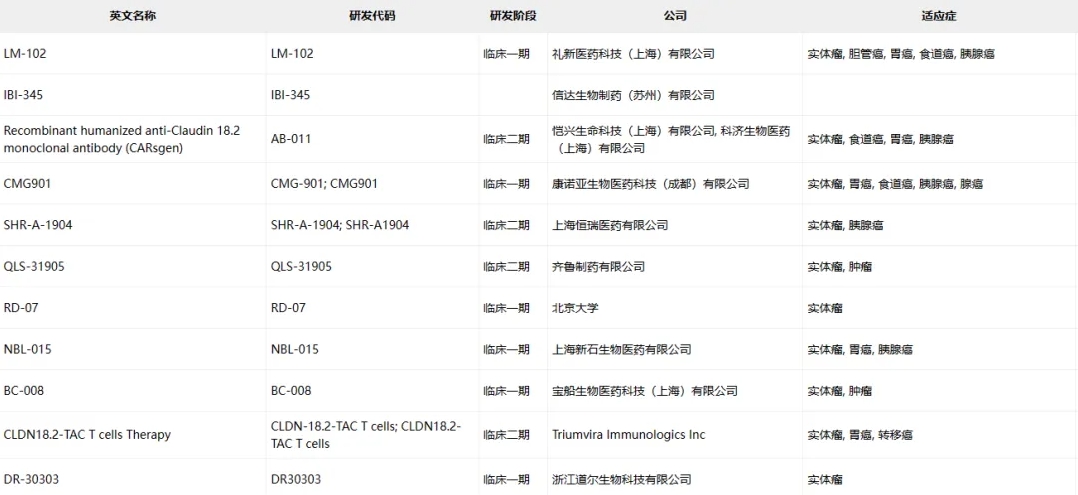
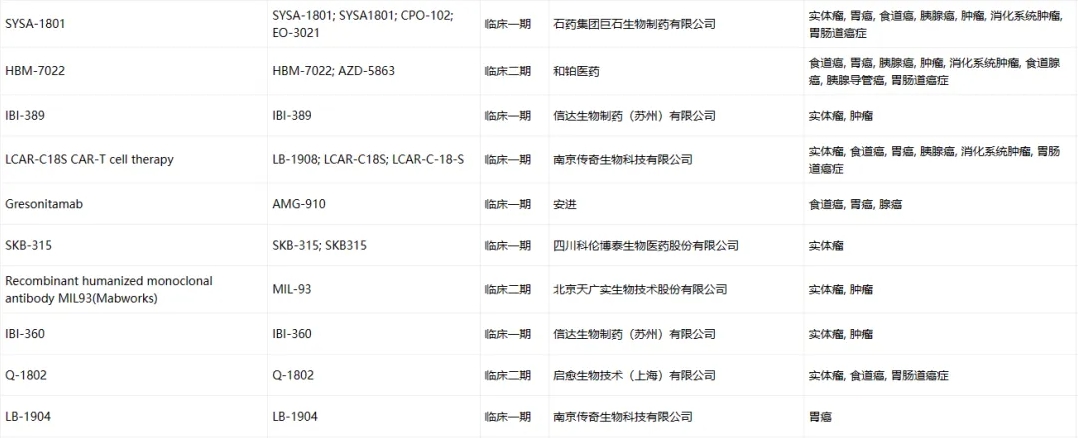
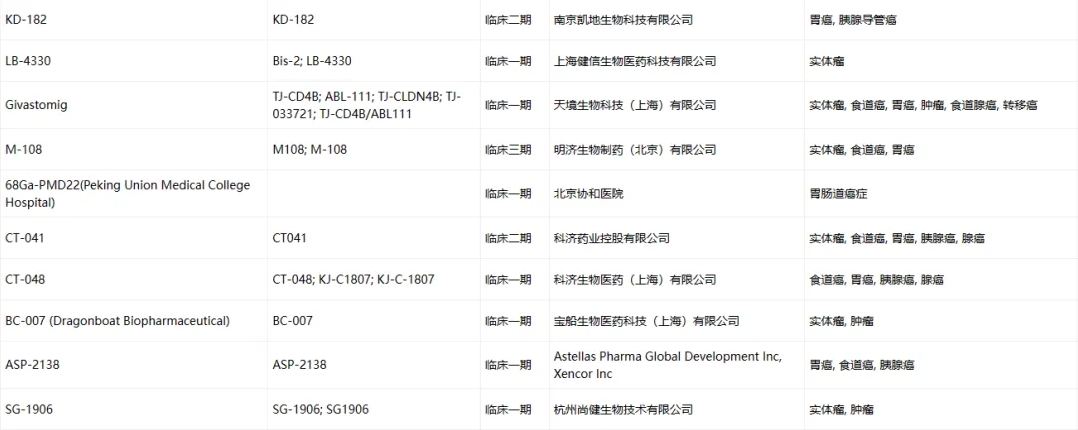
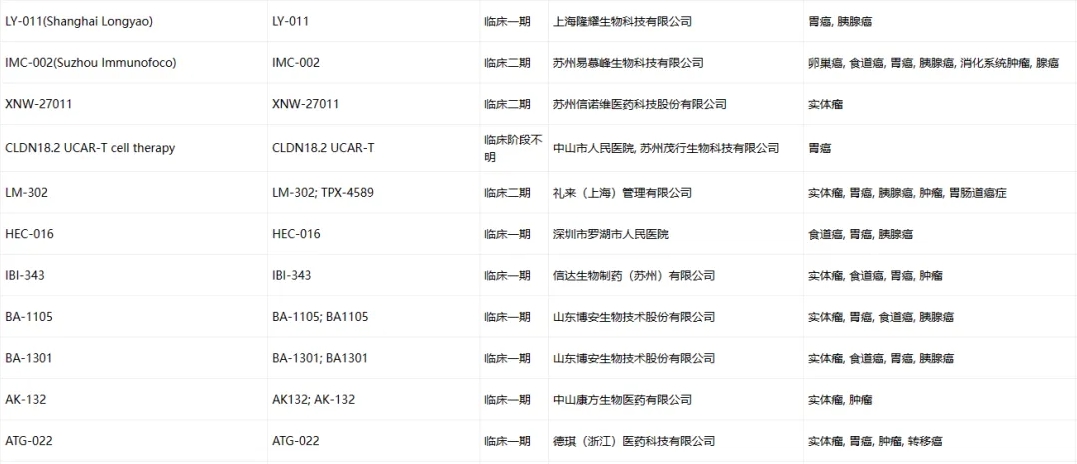
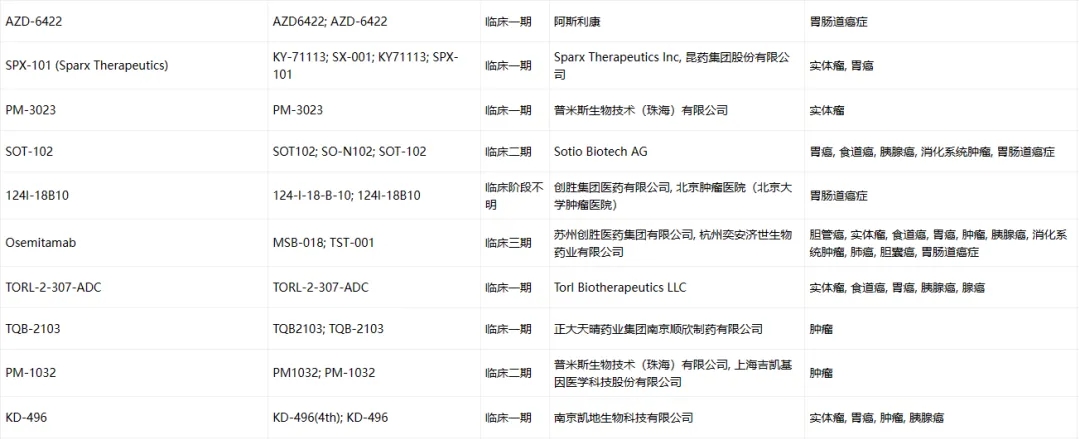
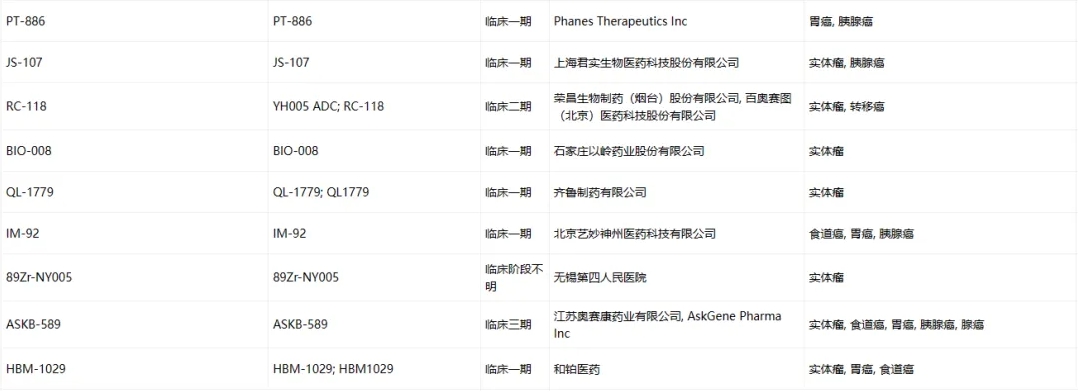
数据来源于ACRO官网统计

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34458
34458

 医药地理
医药地理
 2018.10.22
2018.10.22
 18861
18861

 医谷
医谷
 2019.03.18
2019.03.18
 18841
18841