 研发追踪
研发追踪
 医药魔方
医药魔方
 2024.04.07
2024.04.07
 911
911
4月5日,传奇生物/强生联合宣布,美国FDA已批准Carvykti(西达基奥仑赛,cilta-cel)用于治疗复发或难治性多发性骨髓瘤(R/R MM)患者,这些患者既往至少接受过一线治疗,包括一种蛋白酶体抑制剂(PI)和一种免疫调节剂(IMiD)且对来那度胺耐药。Carvykti是首个且唯一获批用于多发性骨髓瘤患者二线治疗的B细胞成熟抗原 (BCMA) 靶向疗法,包括CAR-T疗法、双特异性抗体和抗体药物偶联物(ADC)。

FDA的批准是基于CARTITUDE-4研究的积极结果,该研究评估了Carvykti与泊马度胺、硼替佐米和地塞米松(PVd)或达雷妥尤单抗、泊马度胺和地塞米松(DPd)对比,在既往接受过1-3线治疗后复发且来那度胺耐药的多发性骨髓瘤患者中的疗效和安全性。既往接受1-3线治疗且来那度胺难治的R/R MM患者随机接受cilta-cel(n=208)或医生选择方案(n=211)。
结果显示,cilta-cel组mPFS显著改善(NR vs 11.8个月,HR=0.41,95%CI 0.30-0.56,p<0.0001),达到主要终点;关键次要终点ORR同样显示获益(85% vs 68%,p<0.0001),不过FDA注意到cilta-cel组死亡导致的PFS事件比例更高(8% vs 2%)。
目前,中期OS数据尚不成熟(34% information fraction),两组中位OS分别为未达到和26.7个月(HR 0.78,95%CI 0.51-1.20)。两组的OS Kaplan-Meier曲线在~11个月时交叉,即前~11个月中cilta-cel组具有更低的OS。安全性方面,cilta-cel与既往报道结果基本一致。
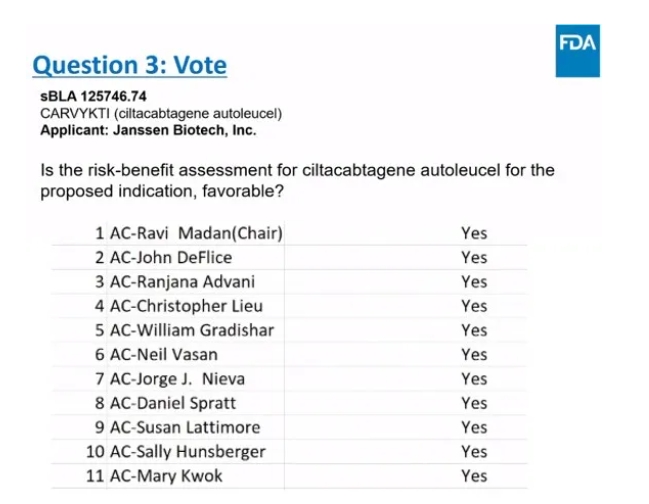
今年3月15日,FDA ODAC(肿瘤药物咨询委员会)会议中专家组以11票赞同,0票反对的结果,认为Carvykti用于既往至少接受过1线治疗(包括PI和IMiD且来那度胺难治)的R/R MM成人患者具有有利的获益-风险结果。
传奇生物首席执行官黄颖博士表示:“Carvykti适应症的扩大有望改变多发性骨髓瘤的治疗格局,为医生和患者提供了一种可在早期治疗方案中使用的个性化免疫疗法。多发性骨髓瘤是一种无法治愈且不断进展的血液肿瘤,会导致患者复发并产生耐药,因此亟需创新的治疗选择。我们致力于改善血液肿瘤患者的生活质量,并持续努力开发出能够为患者带来治愈希望的细胞疗法。“

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34459
34459

 医药地理
医药地理
 2018.10.22
2018.10.22
 18862
18862

 医谷
医谷
 2019.03.18
2019.03.18
 18842
18842