 研发追踪
研发追踪
 动脉新医药
动脉新医药
 2024.04.22
2024.04.22
 680
680
4月15日,罗氏宣布,CD3/CD20双抗格菲妥单抗(商品名:Columvi)用于复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的Ⅲ期STARGLO研究达到了总生存期这一主要终点,与利妥昔单抗联合奥沙利铂治疗组相比,接受格菲妥单抗联合吉西他滨以及奥沙利铂治疗的患者总生存期具有统计学意义的改善。
本次公布的Ⅲ期STARGLO研究是一项随机、多中心、开放标签的临床试验,旨在评估格菲妥单抗联合吉西他滨+奥沙利铂与利妥昔单抗+奥沙利铂相比,用于既往已接受过至少一种治疗且不适合自体干细胞移植的DLBCL患者的疗效和安全性。
此次研究的终点指标包括总生存期(OS,主要终点),无进展生存期(PFS)、完全缓解率(CR)、客观缓解率(ORR)、客观缓解持续时间等次要终点,以及安全性和耐受性。研究结果显示,格菲妥单抗联合治疗组能够显著改善患者OS,此外其安全性与单个药物已知安全性一致。罗氏将在之后的医学会议中报道这一研究数据。
格菲妥单抗
有何特别之处?
根据罗氏公开资料,格菲妥单抗是一款靶向CD20和CD3的双特异性T细胞衔接蛋白。它具有独特的2:1结构,包含两个可以与CD20结合的蛋白域和一个可以与CD3结合的蛋白域。此双重靶向策略可使T细胞靠近B细胞,并活化T细胞以释放癌细胞毒杀蛋白,同时它与已经获批的抗CD20单克隆抗体联用时可以获得更好的效果。
Columvi也是首个获得美国FDA加速批准和欧盟委员会有条件上市的固定时间治疗的双特异性抗体,用于治疗接受过两线或两线以上全身治疗的R/R DLBCL患者。该批准是基于Columvi作为单药在关键1/2期研究NP30179中所取得的积极结果。
2023年3月25日,格菲妥单抗在加拿大拿到全球首批。2023年6月16日又在美国取得监管批准。2023年11月8日,格菲妥单抗获得药监局批准上市,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤成人患者。作为全球首个对R/R DLBCL患者进行固定周期治疗的双抗,格菲妥单抗在国内的获批也标志着中国淋巴瘤治疗进入双抗时代。
Glofitamab是继Mosunetuzumab之后,罗氏成功开发的第二款CD3/CD20双抗,也是罗氏T细胞接合器双特异性抗体产品组合的又一大突破。
两款药物都在治疗淋巴瘤方面取得显著成果,虽都能够增强T细胞对恶性B细胞的杀伤作用,但它们在分子结构、作用强度、主攻瘤种和应用场景等方面存在差异,因此可以相互补充,覆盖更广泛的淋巴瘤患者群体。
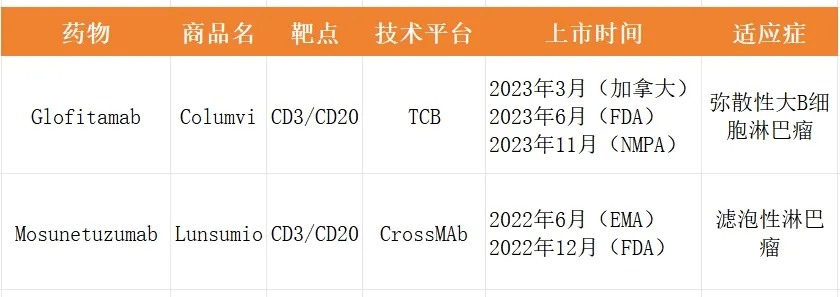
在结构设计方面,Glofitamab采用2:1型非对称双特异抗体的结构,其中两个Fab可以与肿瘤细胞表面的CD20结合,另外一个Fab与T细胞表面的CD3抗原结合,从而增强抗体与肿瘤细胞表面抗原的结合。mosunetuzumab则采用1:1型、IgG1样双特异性抗体结构,其中一个Fab与肿瘤细胞表面的CD20结合,另外一个Fab与T细胞表面的CD3抗原结合。
由于2:1形式的抗体具有有更强的杀伤效果,因此glofitamab的作用强度更强,可以在安全耐受的前提条件下加强杀伤肿瘤细胞的能力,对侵袭性和难治淋巴瘤行之有效。而mosunetuzumab的疗效则相对温和,细胞因子释放综合征(CRS)发生概率相对较低,更适用于治疗滤泡性淋巴瘤(FL)等惰性淋巴瘤。
由于glofitamab作用强度较大,细胞因子释放综合征(CRS)发生概率相对较高(70%左右),需要在治疗期间监测患者的安全性,因此需要住院治疗。而mosunetuzumab的 CRS发生率较低(39%左右),且大部分为低级别。因此mosunetuzumab用药场景会更为灵活,适用于门诊和社区医院环境,更符合中国患者的实际情况。
这两款药物事实上是罗氏根据不同的临床场景,通过不同的技术平台深植于分子设计,以互补的形式触及现实中更多的治疗场景,实现了更广泛的淋巴瘤患者群体覆盖。
CD20/CD3双抗之战
在2018年的ASH大会上,5款CD20/CD3双抗亮相,展现了比肩CAR-T疗法的临床疗效,令CD20/CD3双抗很快成为国内外制药巨头布局血液肿瘤双抗的一大重点方向。
目前FDA共批准3款CD20×CD3 TCE上市,2款来自罗氏,1款来自艾伯维,全部为加速批准上市,用于治疗FL和DLBCL。加上排队中的CD20/CD3药物,将迎来一波激烈的市场竞争。
罗氏是第一个将CD20/CD3双抗药物推向市场的公司。2022年6月,罗氏的第一款CD20/CD3双抗Mosunetuzumab(商品名Lunsumio)获得了欧盟委员会有条件上市批准(3线+复发性/难治性滤泡性淋巴瘤),成为全球首个获批上市CD20/CD3双抗。之后,Genmab/艾伯维的Epcoritamab、罗氏的第二款CD20/CD3双抗Glofitamab陆续获得批准上市。
Genmab/艾伯维的Epkinly与罗氏的两款CD20/CD3双抗最主要的区别在于给药方式,前者为皮下注射,具有更好的临床便利优势。不过,罗氏同样在开发Lunsumio的皮下制剂。
利妥昔单抗的推出为罗氏打开了淋巴瘤治疗市场的大门,同时也为罗氏在淋巴瘤治疗领域的研究和开发奠定了坚实的基础。在此基础上,罗氏开发的两款CD3/CD20双抗则是为了满足治疗淋巴瘤的不同需求和临床场景,可以相互补充,从而覆盖更广泛的淋巴瘤患者群体。
国内布局者亦不少,嘉和生物、正大天晴、君实生物等CD20/CD3双抗都处在临床阶段。在日益白热化的CD20/CD3赛道上,后来者要对已上市的竞品构成实质性挑战,面临差异化竞争门槛更高。
英文链接:https://www.roche.com/media/releases/med-cor-2024-04-15

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34504
34504

 医药地理
医药地理
 2018.10.22
2018.10.22
 18886
18886

 医谷
医谷
 2019.03.18
2019.03.18
 18879
18879