 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻
 2024.04.30
2024.04.30
 101
101
2024年ASCO大会将于5月31日-6月4日美国伊利诺伊州芝加哥举行。今年,中国本土创新药企业继续闪耀登场,多项数据入选口头摘要(Oral),快速口头摘要(Rapid Oral),临床科学研讨会(Clinical Science Symposium)。据不完全统计,本次中国药企在会议中展示的药物类型涵盖小分子药、单抗、双抗、抗体偶联药物(ADC)、CAR-T、PROTAC等,其中有14家企业预计将于本次会议中,展示相关ADC的最新临床动态。
国产ADC即将披露的临床动态
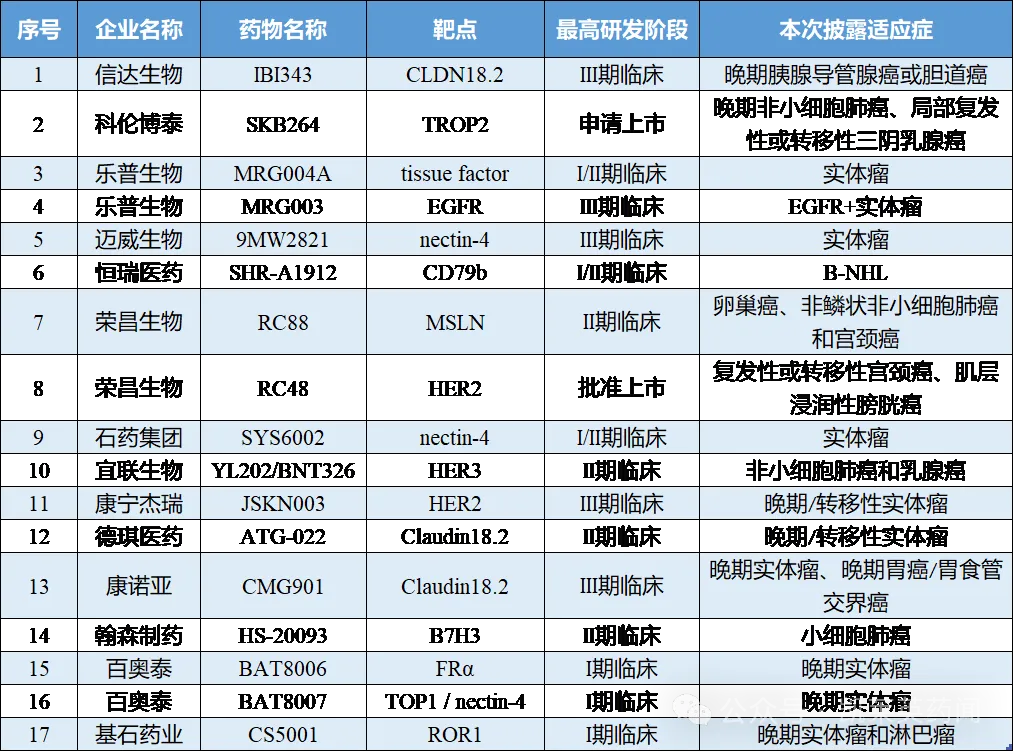
信达生物
信达生物是一家致力于研发、生产和销售肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域创新药物的生物制药公司,将在本次会议上公布约20项最新临床研究数据,包括公司旗下一系列单抗、双抗及ADC在研管线,及达伯舒®(信迪利单抗注射液)、耐立克®(奥雷巴替尼)、他雷替尼(ROS1抑制剂)等创新肿瘤药物。
本次披露的ADC药物IBI343是一款具有全球首创潜力的靶向Claudin 18.2的ADC分子,基于Synaffix的GlycoConnect®实现了对细胞毒素Exatecan的糖基定点偶联。该药物在多种不同表达量的肿瘤细胞系上,展现了良好的Claudin 18.2特异性的体外杀伤活性,并在多种人源肿瘤异种移植小鼠模型上展现了良好的肿瘤抑制活性。基于糖基的定点偶联技术显著增强了整个ADC的稳定性。IBI343在恒河猴的GLP毒理实验中展现了良好的安全性,并在高至30 mg/kg的剂量下耐受性良好。目前,IBI343针对Claudin 18.2阳性HER2阴性胃癌的临床三期试验正在筹备中。
科伦博泰
科伦博泰是一家专注于肿瘤、免疫及其他治疗领域的创新药研发、制造及商业化的生物医药公司;公司在ADC 开发方面积累了超过十年的经验,以应对特定疾病领域如肿瘤学、自身免疫性疾病及代谢疾病的医疗需求。
本次披露的SKB264是中国首款国产TROP-2 ADC,拥有高DAR 值(7.4),毒素选择了新型波里替康衍生的拓扑异构酶I(TOPO1)抑制剂,具有中等的细胞毒性。专有的Kthiol 设计策略通过使用一种全新碳酸盐连接,利用酸性肿瘤微环境选择性地向肿瘤组织释放细胞毒性载荷。目前已被CDE授予4项突破性疗法认定,分别用于晚期或转移性TNBC、晚期或转移性EGFR突变非小细胞肺癌(NSCLC)、晚期或转移性EGFR突变非小细胞肺癌(NSCLC)、以及晚期、复发或转移性PD-L1阴性三阴性乳腺癌(TNBC)。2023年12 月,SKB264 上市申请获受理并纳入优先审评审批,适应症为晚期三阴性乳腺癌(TNBC)。
此前披露的全球1/2 期试验所得出的初步临床数据显示SKB264 在多类经过大量预治疗的晚期实体瘤中显示出令人鼓舞的疗效及潜在的良好安全性。在59 例经治的转移性三阴乳腺癌(mTNBC)患者中,客观缓解率(ORR)为42.4%,疾病控制率(DCR)为76.3%,中位持续缓解时间(mDoR)为11.5 个月,中位无进展生存期(mPFS)为5.7 个月,中位总体生存期(mOS)长达16.8 个月,12 个月和24 个月OS 率分别为65%和39.5%,近40%的患者可生存超过2 年。在TROP2 高表达(H-score>200,n=32)的患者亚组中,ORR 为53.1%,mDoR 为11.1 个月,mPFS 为5.8 个月,mOS 尚未达到,而12 个月及24 个月OS 率分别为65.3%及57.3%。非头对头数据比较在ORR 与mPFS上优于Trodelvy 和DS-1062。疗效优异的同时,安全性整体良好,评分大于3 的不良反应发生率为59.3%,小于Trodelvy(64%)。
此外,治疗非小细胞肺癌的I/II 期数据显示:在EGFR 野生型亚组中,ORR 为26%,DCR 为89%,mPFS 为5.3 个月。在TKI 耐药EGFR 突变体NSCLC 亚组中ORR 为60%,DCR 为100%,mPFS 高达11.1个月,SKB264 治疗TKI 耐药EGFR 突变型NSCLC 的疗效尤其优异,且安全性良好未观察到副作用导致的停药和致死事件。
乐普生物
乐普生物是一家立足中国、面向全球的聚焦于肿瘤治疗领域(尤其是靶向治疗及免疫治疗)的创新型生物制药企业,致力于通过先进的ADC技术开发平台开发创新型ADC,开发出更优化、更创新的药物,更好地服务于癌症患者的未被满足的临床需求;并与公司已上市PD-1单抗普特利单抗开发IO+ADC 联用疗法,充分发挥管线协同作用。此外,公司还通过合作引进溶瘤病毒产品,建立了丰富且差异化管线。
本次ASCO,乐普生物共有三项研究入选,两项临床研究成果获口头报告;分别是ADC药物MRG003、MRG004A,以及PD-1抗体普特利单抗(HX008)。
1、MRG003
MRG003是一种由EGFR靶向单抗与强效的微管抑制有效载荷MMAE分子通过vc链接体偶联而成的ADC,其以高亲和力特异性地结合肿瘤细胞表面的EGFR,通过内吞进入肿瘤细胞后释放强效的有效载荷,从而导致肿瘤细胞死亡。此前,该药物用于治疗晚期鼻咽癌(NPC)获得美国食品和药物监督管理局(FDA)授予快速通道资格(FTD)、并获CDE突破性治疗药物(BTD)认定。目前,MRG003 针对NPC的注册性IIb 期临床已完成入组,预计将于2024 年申报上市;针对头颈鳞癌(HNSCC)的III 期临床正在进行中;针对NPC 及HNSCC适应症在美国获批IND。
在针对NPC 的IIa 期研究中,既往经至少一线含铂方案和PD-1/L1 抑制剂治疗失败或不耐受的患者分别接受MRG0032.0mg/kg(n=30)或2.3mg/kg(n=31)治疗。主要研究终点是按照RECIST 1.1 标准评估的ORR,次要研究终点包括DCR、DoR、PFS 和安全性。结果显示:截至2023 年3 月15 日,2.0mg/kg 剂量组共有28 例患者可评估,ORR 为39.3%,DCR为71.4%,mDoR 为6.8 个月,mPFS 为7.3 个月。2.3mg/kg剂量组共有29 例患者可评估,ORR 为55.2%,DCR 为86.2%,mDoR 为6.8 个月,mPFS 未成熟。在安全性上,大多数常见的治疗相关不良事件(TRAEs)包括皮疹(49.2%)、瘙痒(41.0%)、贫血(34.4%)和脱发(31.1%);根据CTCAE 5.0 标准,大多数TRAEs 为1 级或2 级。治疗相关的严重不良事件(SAE)的发生率为11.5%(7/61)。由于TRAEs 的剂量降低发生率为13.1%(8/61),3 名患者停止了治疗(4.9%)。未观察到与治疗相关的死亡事件。
2、MRG004A
MRG004A是一种组织因子(tissue factor,TF)靶向并通过定点偶联获得的创新ADC药物;采取差异化设计,选择高TF 亲和力的人源化抗TF 单抗实现快速内化,1 个小时内即可观测到MRG004 发生内化,对凝血的影响最小。该药物已获得FDA授予孤儿药资格认定和快速通道资格;临床前研究试验中,在多个TNBC、卵巢癌及PDAC的CDX 与PDX 模型中观察到MRG004A 体内抗肿瘤活性。目前,该药物正在美国及中国进行I/II期临床研究,并已在胰腺癌、三阴乳腺癌及宫颈癌等适应症中观察到抗肿瘤活性信号。
迈威生物
迈威生物是一家全产业链布局的创新型生物制药公司,开发了多个 ADC 技术平台;目前主要专注于肿瘤和年龄相关疾病,涉及肿瘤、自身免疫、代谢、眼科、感染等治疗领域。在本次ASCO中,公司将以口头报告形式公布靶向9MW2821 用于多项晚期实体瘤的 I/II 期临床研究结果。
9MW2821为迈威生物首款靶向 Nectin-4 的定点偶联 ADC 新药,为公司利用 ADC 药物开发平台联合自动化高通量杂交瘤抗体分子发现平台两项平台技术开发的创新品种,是国内企业同靶点药物中首个开展临床试验的品种。9MW2821 已在国内开展多项临床研究,评估其在多种晚期实体瘤患者中的安全性、耐受性、药代动力学特征及治疗效果。
9MW2821 单药治疗经铂类化疗和 PD-(L)1 抑制剂治疗的局部晚期或转移性尿路上皮癌的 III 期临床研究已正式启动,与 PD-1 抑制剂联合用药的 I/II 期临床研究也在推进中,均已完成首例受试者入组。于 2024 年 2 月获 FDA 授予“快速通道认定” (FTD) 用于治疗晚期、复发或转移性食管鳞癌。目前是全球首款针对食管癌和宫颈癌适应症披露临床有效性和安全性数据的靶向 Nectin-4 的治疗药物。
恒瑞医药
恒瑞医药深耕医药行业五十余载,近年来研发投入不断增加;公司潜心打造技术平台,跻身国际一流水平,现有平台种类丰富,涵盖双抗、ADC等大分子药物,以及PRORAC新型小分子药物、基因治疗药物,AI分子设计平台。
本次披露的ADC药物SHR-A1912是一款靶向CD79b的ADC,可以与表达CD79b的肿瘤细胞特异性结合,经肿瘤细胞内吞后在溶酶体内水解释放小分子毒素,从而诱导肿瘤细胞凋亡。2024年2月,该药物是继SHR-A2009获得FDA授予快速通道资格,用于治疗经第三代EGFR酪氨酸激酶抑制剂和含铂化疗后疾病进展的EGFR突变的转移性非小细胞肺癌(NSCLC)后的第二款FTD。此前,SHR-A1912用于B细胞非霍奇金淋巴瘤(B-NHL)治疗的临床试验申请已获得美国FDA默示许可,SHR-A1912单药及联合免疫化疗用于B细胞非霍奇金淋巴瘤治疗的临床试验申请也相继获得中国国家药品监督管理局(NMPA)的许可,目前已进入II期临床试验阶段。本次会议披露的最新进展即是针对B-NHL适应症。
荣昌生物
荣昌生物专注差异化抗体和ADC 药物的开发,目前已经构建具备全球竞争力的产品管线,
1、RC48
维迪西妥单抗(RC48)是中国首个原创ADC药物,是我国首个获得美国FDA、中国药监局突破性疗法双重认定的ADC药物,其用于治疗胃癌、尿路上皮癌的新药,分别于2021年6月、2021年12月在中国获附条件批准上市。2021年8月,Seagen(现被辉瑞收购)以高达26亿美元(包括2亿美元首付款和最高可达24亿美元的里程碑付款),从高个位数到百分之十五以上的销售提成获得了维迪西妥单抗的全球(亚太区除外)独家许可协议,交易额一度刷新中国制药企业单品种海外授权的最高纪录。
本次会议披露的适应症主要集中在复发性或转移性宫颈癌、肌层浸润性膀胱癌中的有效性;根据公司在今年4月在CSCO妇瘤年会披露的数据,一项Ⅱ期、开放标签、多中心篮式设计,在宫颈癌队列评估RC48单药治疗HER2表达的复发性宫颈癌的有效性和安全性的试验中,RC48治疗剂量为2 mg/kg(Q2W)。在疗效可评价的22例患者中,mPFS为4.37个月,mDoR为5.52个月,12个月的OS率为66%,特别是主要研究终点ORR高达36.4%。亚组分析的结果显示,HER2 IHC 1+的患者明显获益(ORR率50%),而且RC48的疗效也惠及了既往经过抗PD1、紫杉醇联合铂类治疗的人群,在复发性宫颈癌的二线及后续治疗中展现出了非常出色的治疗效果。安全性方面,≥3级TRAEs的发生率较低,包括中性粒细胞计数降低(12%)、γ-谷氨酰转移酶升高(8%)和谷丙转氨酶增高(8%),整体安全性可耐受且可控,没有出现眼毒性、肺部毒性或致死性TRAEs。
此外,在膀胱癌适应症上,根据此前披露的RC48-C005/C009研究数据,维迪西妥单抗用于既往化疗失败的膀胱癌患者中,对于肿瘤的客观缓解率依然可以打到50.5%,中位进展时间5.9个月,中位生存时间14.2个月。有效的延长了患者生存时间。
2、RC88
RC88是荣昌生物自主研发的靶向MSLN的ADC药物,目前正处于II期临床试验阶段。2023年3月,RC88联合特瑞普利单抗治疗晚期恶性实体瘤患者的I/II期临床研究申请获CDE批准;2023年12月,RC88用于妇科肿瘤的一项Ⅱ期临床试验申请,已获得美国FDA许可,即将在美国、中国、欧盟等多个国家和地区开展国际多中心临床研究。2024年1月,该药物获得FDA授予的快速通道资格(FTD),用于铂耐药复发性上皮性卵巢癌、输卵管癌和原发性腹膜癌(PROC)患者。
石药集团
近日,石药集团发布2023年度报告,公司已有至少6款ADC产品处于临床研究阶段,其靶点涵盖了HER2、Nectin-4、Claudin 18.2、EGFR等,其中有两款ADC已经实现license-out授权合作,进展最快的ADC产品已经处于关键2期临床研究阶段。
SYS6002 是公司研发的重组人源化抗Nectin-4 ADC,采用公司专有的酶催化定点抗体偶联技术。该ADC 产品的连接子稳定性更高、具有更好的安全性和疗效潜能,可与肿瘤表面的特异性受体结合,通过内吞作用进入细胞,释放毒素,达到杀伤肿瘤细胞的作用。2022年10月,SYS6002获CDE批准临床。临床前研究显示,该产品对多种癌症均显示较好的抗肿瘤作用。
2023年2月,石药集团附属公司石药巨石生物与Corbus就SYS6002 (CRB-701)的开发及商业化订立独家授权协议。根据协议条款:石药巨石生物同意授予Corbus在美国、英国、加拿大、澳大利亚等一些国家在该地区开发及商业化该产品的独家授权,石药巨石生物将收取7,500,000美元的首付款,并有权收取最多130,000,000美元的潜在开发及监管里程碑付款、以及最多555,000,000美元的潜在销售里程碑付款。总交易金额高达6.925亿美元。
2024年1月,石药在2024 ASCO-GU上,公布了SYS6002的I期剂量递增数据,旨在评估SYS6002在6个剂量组(0.2、0.6、1.2、1.8、2.7和3.6 mg/kg)的安全性和耐受性,以确定对标准治疗失败或不耐受的晚期实体瘤患者的最大耐受剂量(MTD)和/或II期剂量。除了确定安全性和耐受性外,还对SYS6002 (CRB-701)的药代动力学(PK)和初步抗肿瘤活性进行了评估。结果显示:6个剂量组均入组,0.2-2.7 mg/kg组无剂量限制性毒性(DLT)进展,患者最长随访时间为10个月。药物耐受性良好,大多数不良事件严重程度为1/2级。1/2级治疗相关不良事件发生率>20%包括角膜上皮病变、血液病、高甘油三酯血症、低钠血症、蛋白尿、贫血和干眼。值得注意的是,皮疹和周围神经病变的发生率均为0%。剂量递增队列中,SYS6002 (CRB-701) 的药代动力学(PK)参数与剂量成正比;相对于相似剂量水平下的Enfortumab vedotin(EV),SYS6002具有更长的ADC半衰期和更低的游离MMAE。此外,公司确定了多种剂量的抗肿瘤反应:在0.6mg/kg时疾病稳定;在1.2 mg/kg时发生部分反应,即病变直径总和减少了60%。
宜联生物
宜联生物成立于2020年7月8日,是一家专注于ADC和相关技术的创新药物开发公司。公司开发出最新一代具有自主知识产权的TMALIN®新型抗体偶联药平台技术,可利用肿瘤微环境和传统溶酶体在胞外胞内实现双重裂解机制、兼具高水溶性、高均一性、高体内外稳定性以及肿瘤组织富集特性。
2023年10月,宜联生物与BioNTech达成战略合作和全球许可协议,合作开发靶向HER3的下一代ADC;根据协议条款,宜联生物将授予BioNTech其所拥有的一款ADC产品在全球范围内(不包括中国内地、香港和澳门)开发、制造和商业化的独家权利。BioNTech将向宜联生物支付7000万美元首付款,以及额外开发、监管和商业化里程碑付款,潜在总金额超过10亿美元。
YL202是基于TMALIN技术平台所开发的第二款产品,有望为TMALIN技术平台完成临床概念验证提供新的依据,为全球肿瘤患者提供更安全有效的治疗选择。据悉,YL202已在美国顺利完成临床1期试验的首例患者给药。该试验为一项国际多中心临床研究,旨在评估YL202在晚期非小细胞肺癌和乳腺癌患者中的安全性、耐受性、药代动力学和抗肿瘤活性。
康宁杰瑞
康宁杰瑞生物成立于2015年,专注于抗肿瘤领域生物创新药开发、生产和商业化。公司创建了蛋白质/抗体工程、抗体筛选、多模块/多功能抗体修饰等具有自主知识产权的生物大分子药物发现、研发、生产技术平台。基于先进的技术平台,康宁杰瑞开发了具有显著差异化特点和强大全球竞争力的产品管线,涵盖单域抗体/单抗、多功能抗体及抗体偶联物等抗肿瘤创新药。
JSKN003为靶向HER2双表位的ADC,是公司利用特有的糖基定点偶联平台自主研发。JSKN003结合肿瘤细胞表面的HER2,通过HER2介导的细胞内吞释放拓扑异构酶Ⅰ抑制剂,进而发挥抗肿瘤作用。临床前研究显示,JSKN003较同类药物具有更好的血清稳定性、更强的旁观者杀伤效应和同等的肿瘤杀伤活性,有效地扩大了治疗窗。根据2024 AACR披露的数据,在剂量递增期(Ia)的研究中,JSKN003治疗HER2表达晚期/转移性实体瘤显示出令人鼓舞的疗效信号,HER2阳性乳腺癌患者ORR达到100%。耐受性和安全性良好,未发生DLT,MTD尚未达到。
十
德琪医药
德琪医药是一家致力于研发、生产和销售同类首款及/同类最优血液及实体肿瘤疗法的商业化阶段生物公司。本次将在ASCO年会上公布四项临床研究进展,包括一项口头报告和三篇壁报展示。
分享的ADC药物ATG-022是一款靶向Claudin 18.2的药物,包含抗Claudin 18.2单抗、可诱导细胞凋亡的毒素和只在细胞内裂解的连接子,具有旁杀伤效应。该药物对于Claudin 18.2有低纳摩尔级别的高亲和力,并具有强效的体内和体外抗肿瘤活性。此外,ATG-022还在Claudin 18.2低表达的病人来源胃癌异种移植模型中显示了较对照药物更为强效的抗肿瘤活性。
康诺亚
康诺亚是一家专注于自免与肿瘤药物创新研发的生物科技企业,目前已搭建4 大核心技术平台,包括:新型T 细胞重定向(nTCE)平台、生物评估平台、创新抗体发现平台和高通量筛选高产抗体药物表达细胞平台。公司管线主要覆盖自免与肿瘤两大领域,目前自主研发的I 类创新药逾30 项,其中9 项已进入不同临床研发阶段。
CMG901(AZD0901)是一款潜在同类首创、靶向Claudin 18.2的抗体偶联药物,通过链接体与单甲基澳瑞他汀E(MMAE)载荷偶联,目前正在晚期实体瘤(胃癌及胰腺癌)患者中开展I期临床研究。近日,公司公告称,阿斯利康已就CMG901治疗晚期实体瘤开展了多项临床研究;一项在表达Claudin 18.2的晚期或转移性胃及胃食管结合部腺癌受试者中比较AZD0901单药与研究者选择的方案作为二线或二线以上治疗的国际多中心III期研究已于 2024年03月在药物临床试验登记与信息平台进行公示,首例受试者已于2024年04月11日完成首次给药。
此前,阿斯利康与公司就潜在全球首创Claudin 18.2 抗体偶联药物CMG901达成全球独家授权协议,子公司KYM Biosciences将获得6300 万美元的预付款和超过11 亿美元的潜在额外研发和销售相关的里程碑付款,以及高达低双位数的分层特许权使用费。
2023年11月,康诺亚公布CMG901治疗晚期胃癌╱胃食管结合部腺癌的I期临床研究最新数据,截至2023年7月24日,2.2mg/kg、2.6mg/kg、3.0mg/kg三个剂量组共纳入113例胃癌╱胃食管结合部腺癌患者(分别为44、50、19例)。所有受试者均接受了至少一线的标准治疗(既往中位治疗线数为2线),74%的受试者既往接受过抗PD-1/PD-L1治疗,结果显示:89例可评估的Claudin 18.2阳性胃癌或胃食管结合部腺癌患者在三个剂量组的确认的客观缓解率(ORR)为33%,确认的疾病控制率(DCR)为70%。其中,2.2mg/kg剂量组确认的ORR为42%,中位无进展生存期(mPFS)为4.8个月,中位总生存期(mOS)尚未达到。安全性方面,与药物有关的≥3级治疗期间出现的不良事件发生率为54%,与药物有关的严重不良事件发生率为31%,8%的受试者因药物相关的不良事件停止用药。
翰森制药
翰森制药深耕医药行业近30 年,在全球化战略布局下,翰森制药加速国际BD合作,积极探索新靶点、拓展新方向、引入新技术,同时努力将自主研发成果推向世界。经过多年积累,公司已拥有高效的大分子、小分子创新药物发现能力,研发布局涵盖单抗、ADC药物、siRNA、双抗及融合蛋白产品等领域。
HS-20093由全人源化的B7-H3单抗与拓扑异构酶抑制剂(TOPOi)有效载荷共价连接而成,目前正在中国进行多项用于治疗肺癌、肉瘤、头颈癌及其他实体瘤的Ⅰ期和Ⅱ期临床研究。根据在2023 ASCO公布的晚期实体瘤中的I期研究数据,结果显示:客观缓解率(ORR)为30.0%,疾病控制率为86.0%,中位无进展生存期(mPFS)为5.4个月。在小细胞肺癌受试者中,ORR为63.6%,所有肿瘤缓解均在首次有效性评估时发生,mPFS为4.7个月,3个月PFS率达72.7%。3例受试者发生过剂量限制性毒性,最大耐受剂量(MTD)为12.0 mg/kg Q3W。
百奥泰
百奥泰致力于开发新一代抗体药物,用于治疗肿瘤、自身免疫性疾病、心血管疾病以及其它危及人类生命或健康的重大疾病。作为新一代抗体药物研发引领者,百奥泰在靶点开发、抗体工程、治疗方法开发、抗体生产等方面,已成功获得若干项国内外专利授权,另有多项专利提交申请或进入审查阶段。
1、BAT8006
BAT8006 是百奥泰开发的靶向叶酸受体 α( FRα )的ADC,由重组人源化抗FRα 抗体与毒性小分子拓扑异构酶 I 抑制剂,通过自主研发的可剪切连接子连接而成,拟开发用于实体肿瘤治疗。 BAT8006 具有高效的抗肿瘤活性,毒素小分子有很强的细胞膜渗透能力,在 ADC 杀伤癌细胞后能释放并杀死附近的癌细胞,产生旁观者效应,有效克服肿瘤细胞的异质性。同时, BAT8006 具有很好的稳定性和安全性,血浆中释放的毒素小分子极低,降低了脱靶毒性的风险。体内外药理研究中,BAT8006表现出高效的抗肿瘤活性,具有best-in-class的治疗潜力。
2、BAT8007
BAT8007 是一款靶向Nectin-4 的ADC 药物,由重组人源化抗 Nectin-4 抗体与毒性小分子拓扑异构酶 I 抑制剂通过公司自主研发的可剪切连接子连接而成,拟开发用于实体瘤治疗。临床前研究显示 BAT8007 具有高效的抗肿瘤活性,毒素小分子有较强的旁观者效应,可望有效克服肿瘤组织的异质性。同时, BAT8007 还表现出较好的稳定性及安全性,血浆中释放的毒素小分子极低,预示了脱靶毒性风险的降低。
基石药业
基石药业专注于研究开发及商业化创新肿瘤免疫治疗及精准治疗药物,建立了一条14种肿瘤候选药物组成的丰富产品管线,其中涵盖4条ADC药物管线。
本次披露的CS5001是一款靶向ROR1的ADC,具有独特的设计,只有在到达肿瘤后,被肿瘤细胞内吞后,在溶酶体中其连接子被在肿瘤细胞中高表达的特异性酶切割释放PBD前毒素,继而PBD前毒素在肿瘤细胞内被激活,从而杀死肿瘤细胞。这种连接子加前毒素的“双控”机制有效地减少与传统PBD载荷有关的毒性问题,而获得更大的安全窗口。
2020年10月,基石药业与LegoChem Biosciences(LCB)就CS5001的开发和商业化达成授权协议。CS5001最初是由韩国领先的生物科技公司LCB和ABL bio共同合成。根据协议条款,基石药业获得独家授权,主导CS5001在韩国以外的全球其他地区的开发和商业化。
临床前研究数据表明:CS5001在多种表达ROR1肿瘤细胞系展现出了较强的选择性细胞毒性,并在血液和实体肿瘤异种移植小鼠模型中均显示出显著的体内抗肿瘤活性。此外,利用定向偶联技术获得精准的药物抗体比率(DAR),便于实现均质生产及大规模生产。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49870
49870

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34839
34839


 2014.03.11
2014.03.11
 31197
31197