 产业资讯
产业资讯
 医药魔方
医药魔方
 2024.05.07
2024.05.07
 119
119
5月3日,CG Oncology宣布,其在研溶瘤病毒疗法cretostimogene(CG0070)单药在治疗对卡介苗治疗无应答、高危非肌层浸润性膀胱癌(NMIBC)患者的有效性和安全性III期研究数据显示,75.2%的患者实现了完全缓解(CR),29例患者维持完全缓解超过12个月。

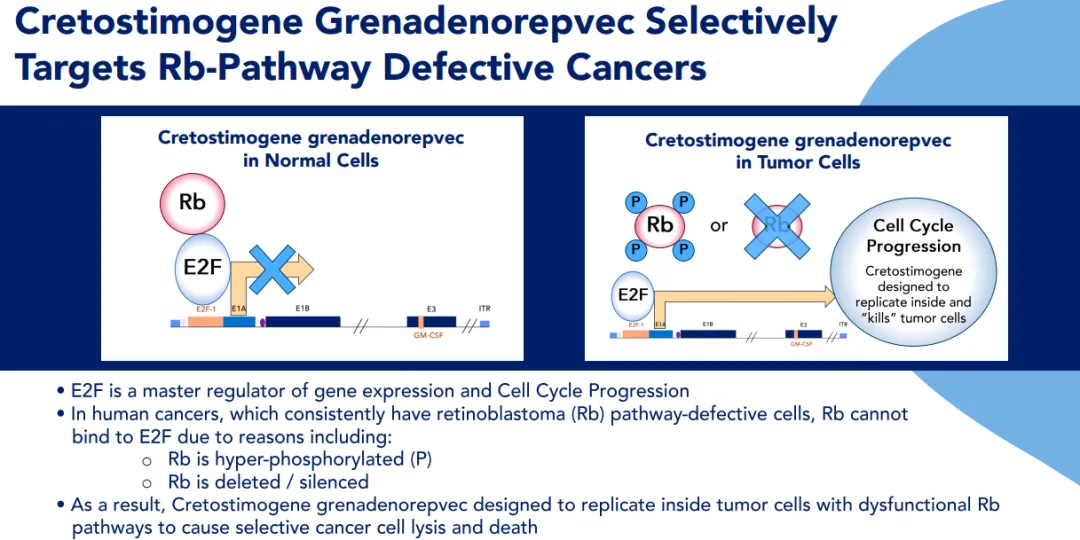
Cretostimogene是一种first in class(FIC)、工程化、条件性复制的溶瘤免疫疗法,通过膀胱灌注给药,其被设计用于在大多数尿路上皮癌中存在的视网膜母细胞瘤(Rb)基因通路缺陷细胞中优先复制,并引发抗肿瘤免疫反应。
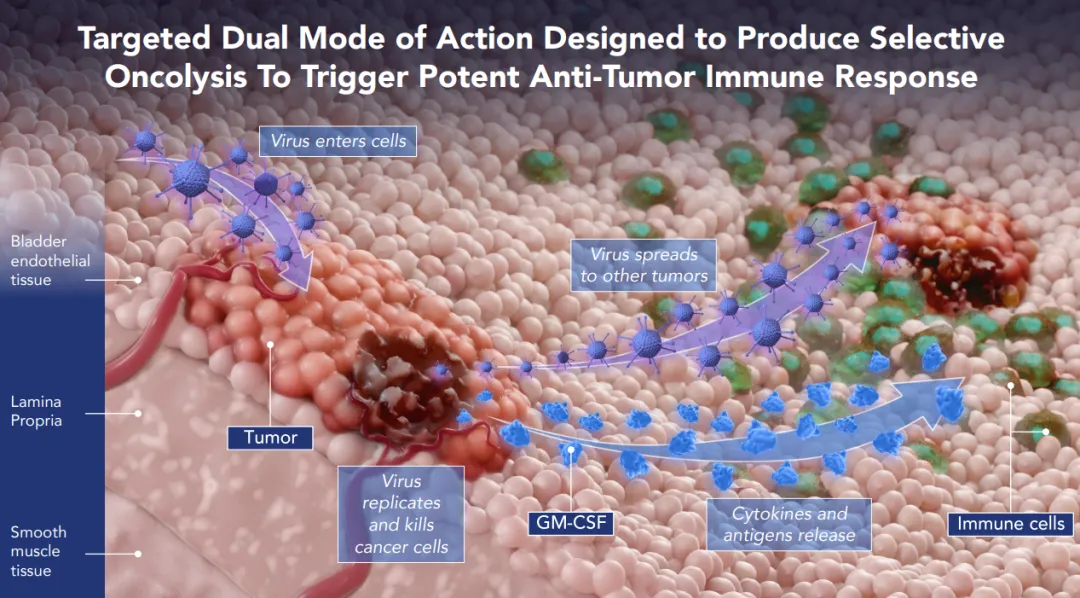
Cretostimogene含一个癌症特异性启动子E2F-1和一个GM-CSF转基因。CG0070被设计成以两种重要和互补的方式工作。首先,其可特异性识别并在肿瘤细胞内复制,导致肿瘤细胞溶解和免疫原性细胞死亡。其次,癌细胞的破裂可以释放出肿瘤衍生的抗原,连同GM-CSF,可以刺激全身的抗肿瘤免疫反应,包括机体自身的白细胞,实现肿瘤杀伤作用。去年12月,美国FDA授予cretostimogene快速通道资格和突破性疗法认定。
Cretostimogene目前正在进行的代号为BOND-003的研究是一项单臂、III期临床试验,旨在评估Cretostimogene单药治疗高危、对卡介苗治疗无应答的NMIBC伴原位癌(CIS)、伴或不伴Ta或T1乳头状肿瘤患者的疗效和安全性。这些患者此前接受过多种治疗,包括膀胱内灌注化疗和全身性免疫疗法。研究的主要终点是任意时间的CR,次要终点为中位缓解持续时间(DOR)。
截至2024年4月1日截止日期,75.2%(79/105)的患者([95%CI: 65-83])在任意时候都达到了CR,29名患者在12个月或更长时间内维持完全缓解,DOR未达到;观察到92.4%的无膀胱切除术生存率;实现完全缓解的患者中,无人接受根治性膀胱切除术,也没有出现淋巴结或转移性进展。
安全性方面,没有3级或以上治疗相关不良事件(TRAEs)或死亡报告,2例患者(1.8%)发生严重TRAEs(2级)。未观察到与cretostimogene相关停药;94.5%的患者完成了所有预期治疗,70例(62.5%)发生TRAE。截至2024年1月31日的安全截止日期,最常见的TRAE(≥10%)为膀胱痉挛、频尿、排尿困难、尿急和血尿。
CG肿瘤学总裁兼首席运营官Ambaw Bellete表示:“我们很高兴最新数据表明,cretostimogene作为一种保留膀胱的治疗方法,可以极大地改善患者的预后和生活质量。”重要的是,BOND-003预计将在2024年底获得关键数据,我们期待向监管部门递交上市申请。”
基于溶瘤病毒和免疫疗法联用的潜力,cretostimogene也在做与其他药物比如Keytruda联用的探索,以求进一步扩大潜在的适应症范围和寻求效用更高的治疗方式。今年1月,CG Oncology凭CG0070在纳斯达克挂牌上市,首日股价大涨96%,市值达到22.5亿美元。
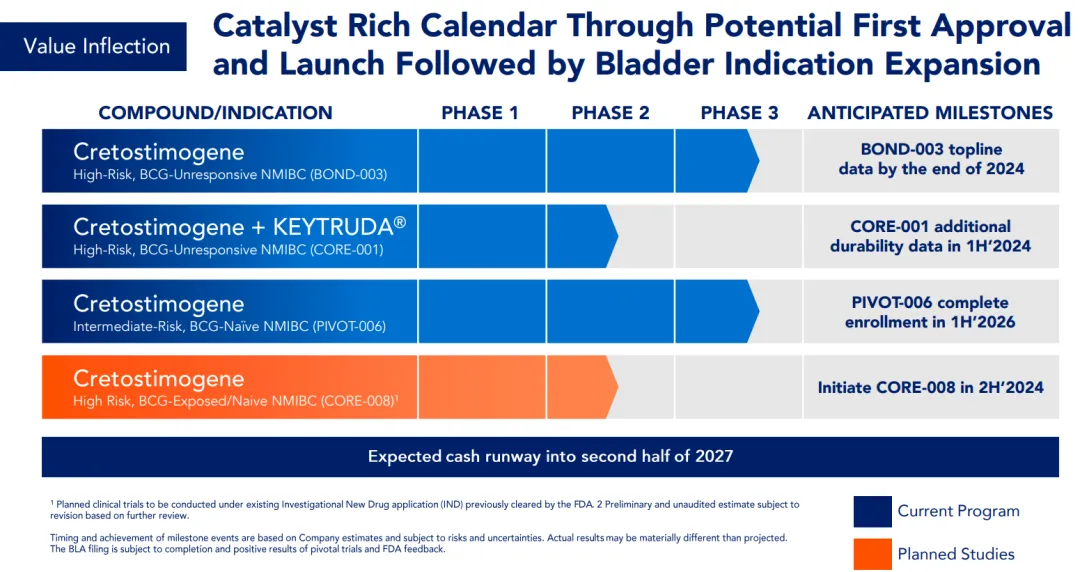
值得注意的是,乐普生物目前拥有在中国内地、香港及澳门进行cretostimogene开发、制造及商业化权利,凭海外积极临床数据,乐普生物可在中国以较低成本和时间完成该款药物的桥接临床试验,快速实现商业化。目前,乐普生物正在中国开展该药物的I期临床试验,患者入组工作正在进行中。

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49869
49869

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34839
34839


 2014.03.11
2014.03.11
 31197
31197