 研发追踪
研发追踪
 新药猎人笔记
新药猎人笔记  2026-01-30
2026-01-30
 103
103
2026年1月28日电】 美国食品药品监督管理局(FDA)于1月28日宣布对生物技术公司Regenxbio(纳斯达克代码:RGNX)的两项基因疗法临床试验实施临床暂停(clinical hold),原因是一名参与试验的5岁儿童在接受治疗后出现脑瘤。
据Regenxbio公司发布的声明,该脑瘤病例出现在RGX-111疗法的I/II期临床试验中。一名5岁患儿在4年前接受脑室内注射RGX-111后,在一次例行脑部MRI检查中被发现患有无症状的脑室中枢神经系统肿瘤。
初步基因分析显示,切除的肿瘤样本中检测到腺相关病毒(AAV)载体基因组整合事件,与原癌基因PLAG1的过度表达相关。PLAG1是一种已知易发生染色体重排的原癌基因。目前,该严重不良事件是否与药物相关的调查仍在进行中,因果关系尚未确立。
FDA在暂停RGX-111试验的同时,还将临床暂停令扩展至RGX-121项目。RGX-121用于治疗黏多糖贮积症II型(MPS
II,又称亨特综合征),此前已提交生物制品许可申请(BLA),原定于2月8日迎来FDA审批决定。
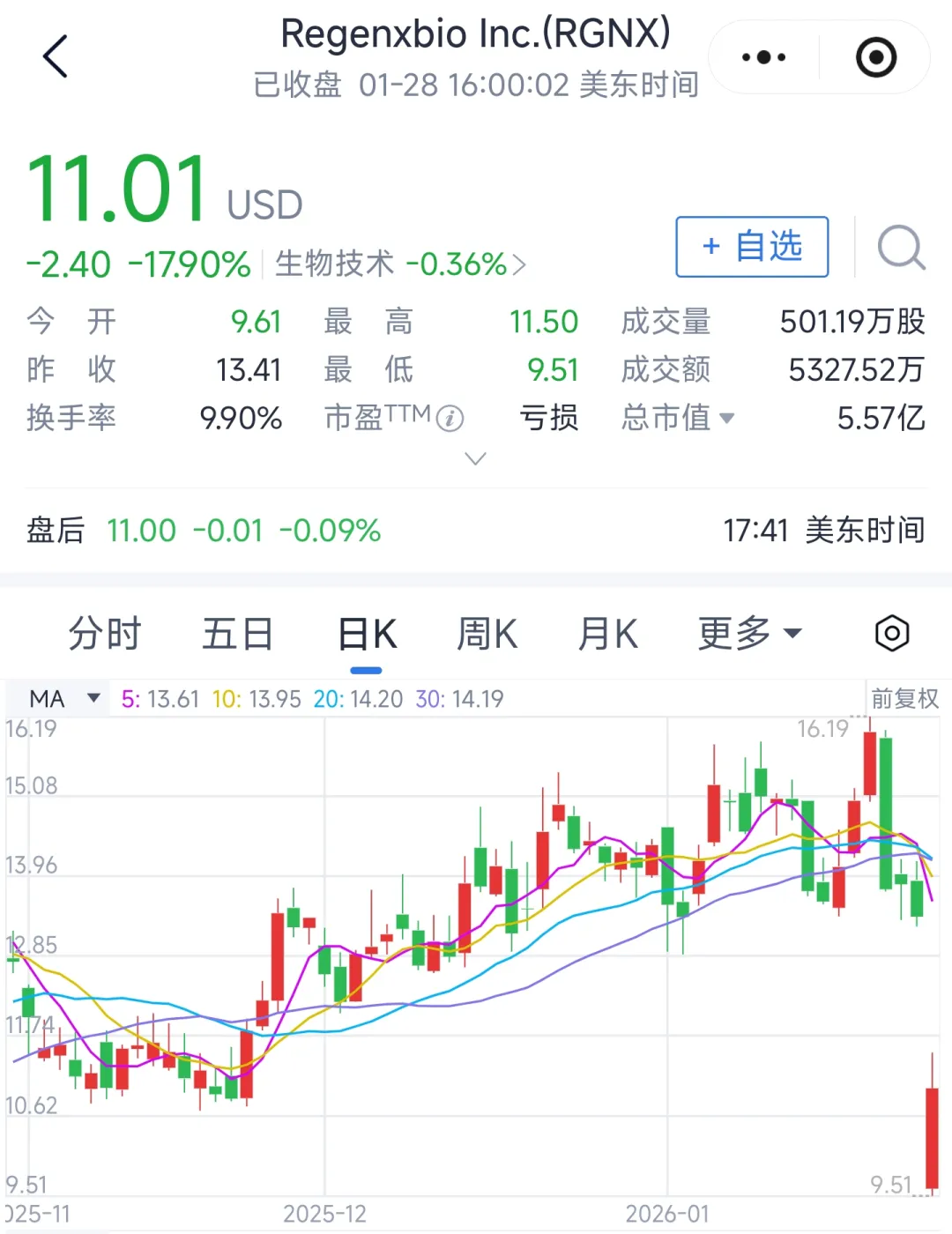
受此消息影响,Regenxbio股价周三暴跌近17.9%,盘前交易中跌幅一度达30%。
结束语:
尽管尚未有明确的原因,但这一挫折进一步揭示了开发基因疗法可能存在的风险。基因疗法对患有不治之症和罕见病的患者充满希望,但也可能带来尚未可知的危险。Capsida Biotherapeutics、Astellas Pharma 和 Sarepta Therapeutics 都曾经报告过在临床试验或上市后接受其基因疗法的患者死亡事件。

 研发追踪
研发追踪
 盛诺一家
盛诺一家  2026-02-02
2026-02-02
 60
60

 研发追踪
研发追踪
 Minhua笔记
Minhua笔记  2026-02-02
2026-02-02
 57
57
 研发追踪
研发追踪
 世界临床药物
世界临床药物  2026-02-02
2026-02-02
 59
59