 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-01-31
2026-01-31
 64
64
1 月 30 日,先为达生物 GLP-1 受体激动剂「埃诺格鲁肽」在国内获批上市,适用于成人 2 型糖尿病患者血糖控制,成为全球首个获批上市的 cAMP 偏向型 GLP-1 受体激动剂。

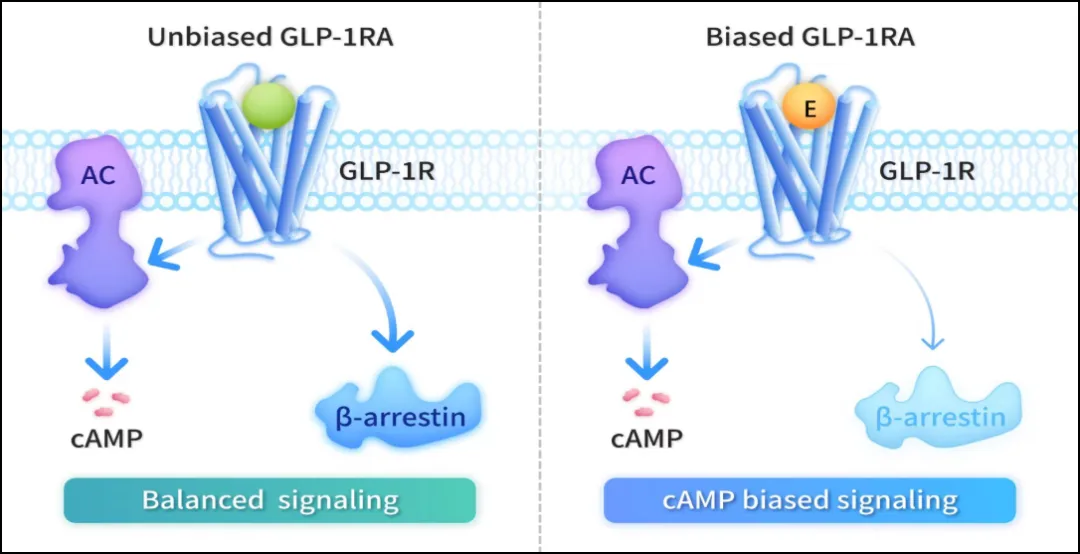
埃诺格鲁肽注射液(Ecnoglutide injection,研发代号:XW003,曾用名:伊诺格鲁肽)是由先为达生物自主研发的全球首创的 cAMP 偏向型长效 GLP-1 受体激动剂。
与非偏向型的
GLP-1 受体激动剂不同,埃诺格鲁肽选择性激活 cAMP 信号通路,同时最小化 β-arrestin
的募集,该独特机制可能是其提升临床疗效与改善代谢获益的关键因素。
相比非偏向型激动剂,偏向型激动剂在多项基础与临床研究中均显示出更高的降糖幅度,并在减少进食和扩大减重幅度方面表现更优。
埃诺格鲁肽作用机制
截图来自:先为达官方资料
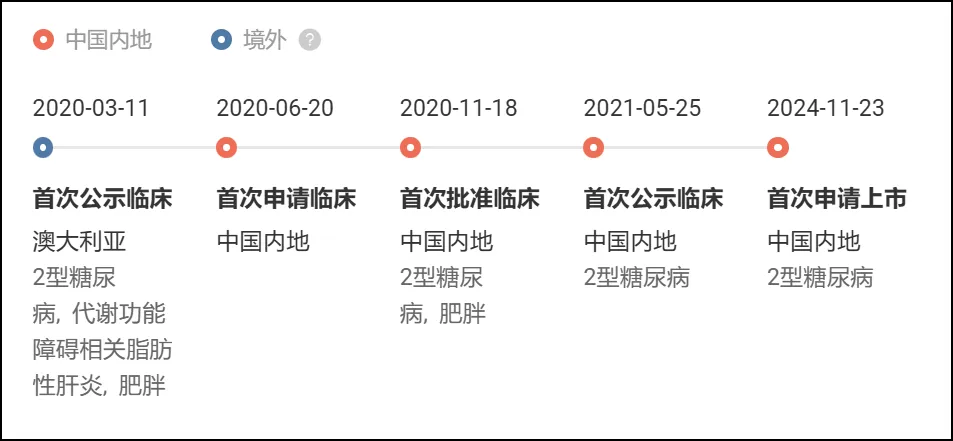
Insight 数据库显示,埃诺格鲁肽最早在 2020 年 3 月首次公示临床,2024 年 11 月在国内申报上市,用于 2 型糖尿病;同年 12 月,又在国内申报了减重适应症。
作为先为达的首款上市产品,今日该药在国内获批上市,意味着先为达的商业化掀开了崭新篇章。另据 Insight 数据库,除注射剂型以外,先为达还在开发埃诺格鲁肽口服片剂(XW004),目前已启动 II 期临床。
项目开发关键节点
截图来自:Insight 数据库网页版,下同
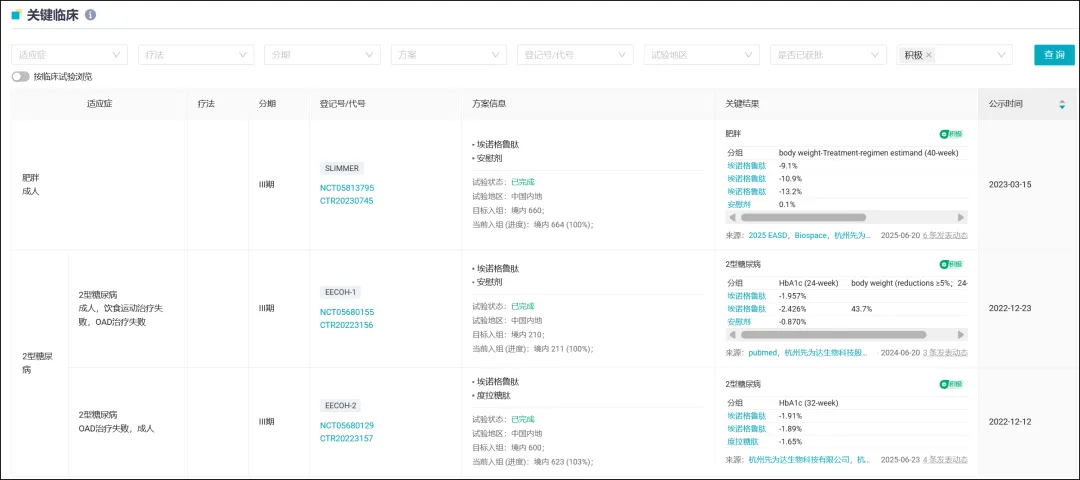
埃诺格鲁肽注射剂目前已有 5 项 III 期临床试验公示,其中 3 项已经公布临床结果,包括针对 2 型糖尿病的 EECOH-1 和 EECOH-2 研究,以及针对肥胖适应症的 SLIMMER 研究。
已公布临床结果的关键研究
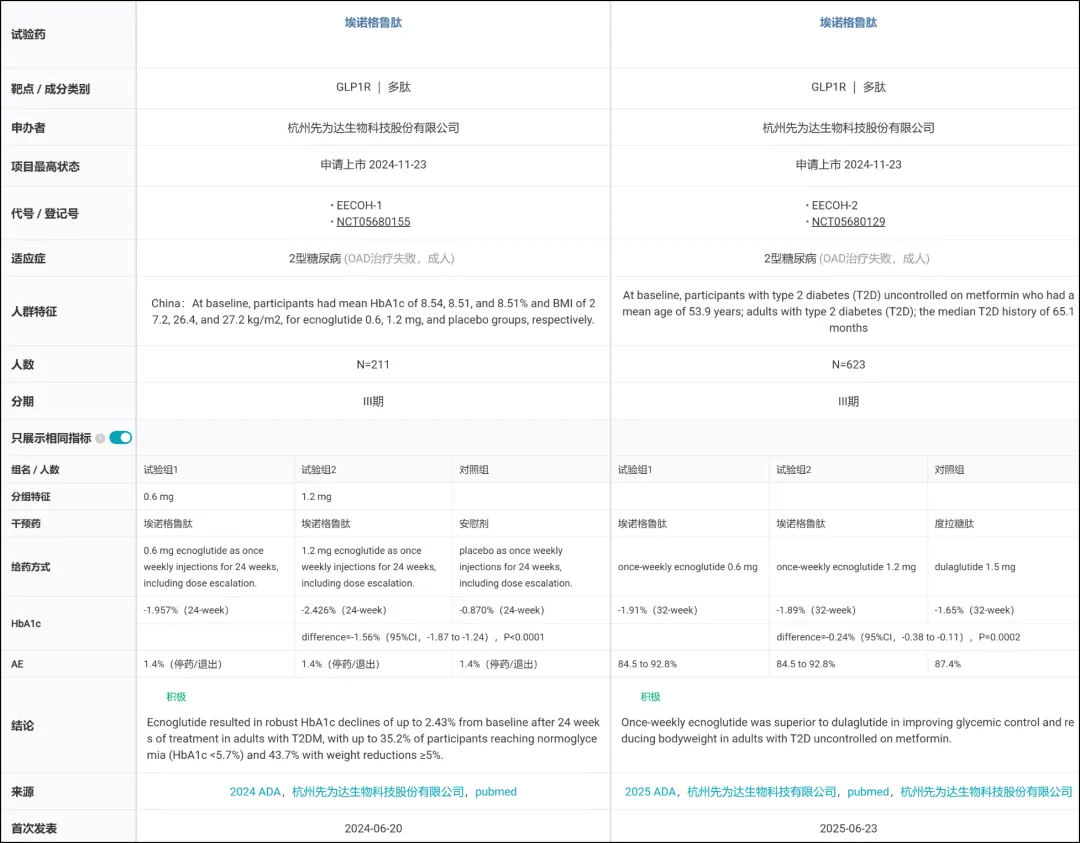
EECOH-1(NCT05680155/CTR20223156)是评估埃诺格鲁肽在饮食运动干预后血糖控制不佳成年 2 型糖尿病受试者中的多中心、随机、双盲、安慰剂对照 III 期临床试验。试验共纳入 211 例患者,随机接受每周一次 0.6 mg、1.2 mg 埃诺格鲁肽或安慰剂治疗 24 周(含剂量递增期),研究的主要疗效终点为治疗 24 周后糖化血红蛋白(HbA1c)相对基线的改变。
结果显示,治疗 24 周后,埃诺格鲁肽显著降低了患者的 HbA1c 水平。
具体而言,经 0.6 mg 和 1.2 mg 埃诺格鲁肽治疗后,患者在 24 周时 HbA1c 分别降低 1.957%(95%CI,-2.18 to -1.73)和 2.426%(95%CI,-2.65 to -2.20),而安慰剂组仅降低 0.870%(95%CI,-1.09 to -0.65)。HbA1c 降低至 7% 以下的患者比例分别为 68.1%、80.3%、21.1%。
EECOH-2 研究是一项多中心、随机、开放、度拉糖肽阳性对照 III 期临床试验,共入组 623 例二甲双胍治疗后血糖控制不佳的成年 2 型糖尿病患者,按 1:1:1 比例随机分配接受每周一次埃诺格鲁肽注射液 0.6 mg、1.2 mg 或度拉糖肽注射液 1.5 mg 治疗,总治疗时长为 52 周。研究的主要终点为治疗 32 周后经由中心实验室检测的 HbA1c 相对基线的改变。
研究结果显示,治疗 32 周后,主要研究终点各剂量埃诺格鲁肽组 HbA1c 降幅,均高于度拉糖肽 1.5 mg 组,较基线平均降幅可达 1.91%,疗效可稳定持续至 52 周。第 52 周时,埃诺格鲁肽 1.2 mg 或 0.6 mg 组 HbA1c < 7.0% 以及 HbA1c ≤ 6.5% 的受试者比例显著高于度拉糖肽 1.5 mg 组。结果表明,各剂量埃诺格鲁肽相对度拉糖肽 1.5 mg 组均可显著降低 HbA1c,且达标患者比例更高。
与度拉糖肽 1.5 mg 相比,埃诺格鲁肽各剂量组针对多种心血管代谢相关危险因素,包括空腹血糖、餐后 2 小时血糖、体重、腰围、臀围、血脂(甘油三酯)、BMI,均有显著改善,带来全面代谢综合获益。
同时,整体安全性和耐受性良好,和其他已上市 GLP-1 受体激动剂类药物相似。最常见不良事件为胃肠道反应和食欲减退,绝大多数为轻、中度,主要发生在剂量递增期。因不良事件终止用药的发生率较低,未发生重度低血糖事件。
针对糖尿病的两项 III 期临床结果对比
而针对肥胖症的 III 期 SLIMMER 临床试验结果也已发表于《柳叶刀·糖尿病与内分泌学》(The Lancet Diabetes & Endocrinology),并在 2025 年美国糖尿病协会(ADA)科学会议上进行了口头报告。
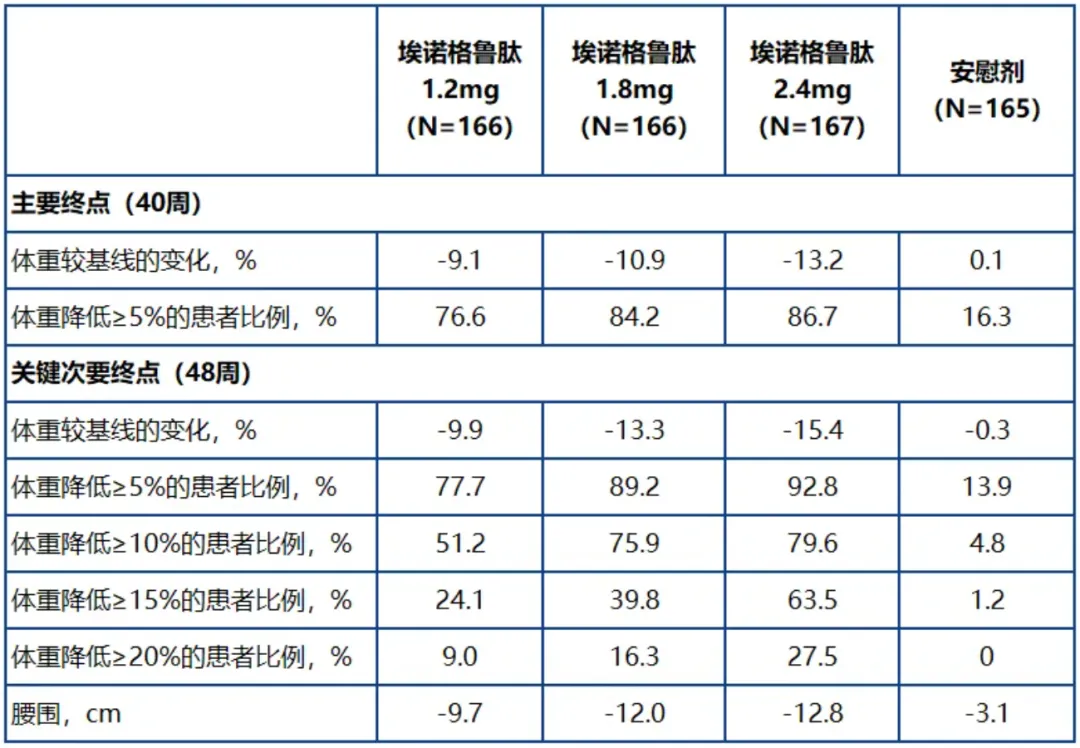
SLIMMER 研究是一项多中心、随机、双盲、安慰剂对照的 III 期临床试验,共入组 664 例肥胖(BMI ≥ 28 kg/m²)或超重(BMI ≥ 24 kg/m² 至 < 28 kg/m²)且至少有一种体重相关合并症的患者,随机接受每周一次埃诺格鲁肽 1.2 mg、1.8 mg 或 2.4 mg 或安慰剂治疗,总治疗时长为 48 周,主要终点为第 40 周时体重较基线的百分比变化和体重较基线降幅 ≥5% 的受试者比例。
基于疗法策略估计目标,第 40 周时,埃诺格鲁肽呈现出剂量依赖性体重降低:
最高剂量(2.4 mg)组平均体重较基线降低 13.2%,而安慰剂组增加 0.1%(p<0.0001)。至第 48 周时,体重降幅进一步提升至 15.4%(安慰剂校正后为 15.1%);
92.8% 的受试者实现 ≥ 5% 的临床意义体重下降,约为安慰剂组的 7 倍;
79.6% 和 63.5% 的受试者分别达到了 ≥ 10% 和 ≥ 15% 的体重下降,超过了其他非偏向型 GLP-1 受体激动剂在类似人群中的结果。
除显著体重降低外,埃诺格鲁肽组可显著改善其他关键的心血管代谢风险指标。此外,平均尿酸水平降幅高达 54.3 µmol/L,高尿酸血症发生率较安慰剂组更低。
值得一提的是,埃诺格鲁肽组显著降低了肝脏脂肪含量。在基线肝脏脂肪含量 ≥ 8% 的受试者中,埃诺格鲁肽 2.4 mg 组第 40 周时肝脏脂肪含量较基线的平均百分比变化达到 -53.1%。所有剂量治疗组的肝酶水平均较安慰剂组显著降低。
关键临床结果
截图来自:先为达官方资料
GLP-1 为首的代谢药物近年来势头正劲,带动赛道领先企业礼来的市值攀越万亿美元高峰。2024 年度,诺和诺德的司美格鲁肽全球销售额接近 300 亿美元,礼来的替尔泊肽也拿下 165 亿美元好成绩。
而在国内,Insight 数据库显示,目前已有 11 款 GLP-1R 激动剂新药获批上市,除礼来的替尔泊肽和信达的玛仕度肽之外,其余均为单靶点药物。先为达的埃诺格鲁肽作为创新 cAMP 偏向型 GLP-1 受体激动剂,有望在红海市场中抢得一席之地。

 研发追踪
研发追踪
 盛诺一家
盛诺一家  2026-02-02
2026-02-02
 50
50

 研发追踪
研发追踪
 Minhua笔记
Minhua笔记  2026-02-02
2026-02-02
 48
48
 研发追踪
研发追踪
 世界临床药物
世界临床药物  2026-02-02
2026-02-02
 49
49