 产业资讯
产业资讯
 药创新
药创新  2026-02-06
2026-02-06
 6
6
AI赋能,开发First-in-class与Best-in-class疗法。
要说2026年最热的医药BD赛道,AI无疑是其中之一。仅在1月,礼来、强生、赛诺菲、阿斯利康、百时美施贵宝(BMS)等头部药企都宣布了AI有关交易,大有争先恐后之势。
实际上,2024年至今,全球营收额TOP10的制药企业,每一家都有AI/机器学习相关交易达成。据Deal Forma统计,2024年全球医药领域共有84起AI/机器学习相关的合作与交易,总金额118亿美元;2025年攀升至114起,总金额434亿美元,金额同比增长270%。
一场关于AI的“军备”竞赛已经在头部药企中打响,其中隐藏着它们的研发策略与增长密码。本文重点关注礼来、阿斯利康和艾伯维,剖析其代表性AI交易如何帮助公司建立独特优势,决胜未来市场。
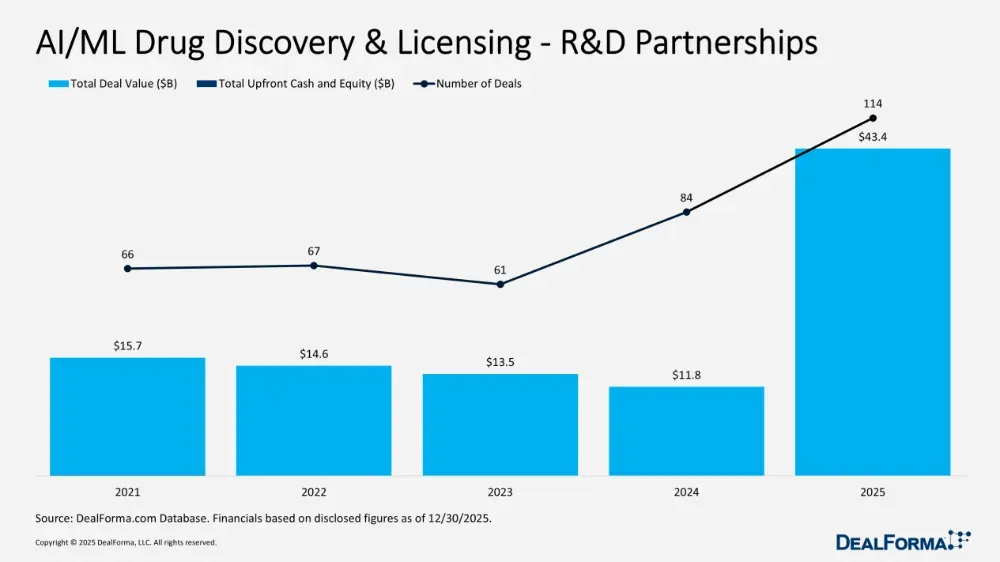
近2年,制药领域与AI/机器学习有关的交易金额快速攀升/图自Deal Forma礼来:加速生物制剂、肽类和抗体药物开发
礼来和英伟达都是各自领域当之无愧的巨头。当它们强强联手,自然会引爆整个制药行业。
今年1月,首个跻身“万亿市值”的药企礼来宣布,与“AI教父”黄仁勋创立的英伟达携手,共建AI联合创新实验室。未来5年内,双方将为此共同投入10亿美元。
礼来原本就是英伟达的大买家。2025年10月,礼来宣布将建设制药行业最强的AI工厂,从英伟达引进超过1000个GPU,用于支持药物发现、研发、配送等环节。GPU即图像处理器,其算力较中央处理器(CPU)呈倍数级增长。如果说CPU是指挥官,GPU就是冲锋陷阵的大军,有了强大的GPU才能真正让现代AI大模型跑起来。
此次共建的创新实验室,将基于英伟达的BioNeMo平台和Vera Rubin架构搭建基础设施。前者帮助礼来减少研发的不确定性,后者帮助礼来在确定发力方向后加速前进。
具体而言,BioNeMo是一个端到端的药物发现与分子设计平台,Vera Rubin则是一个超级计算平台,能够让BioNeMo的能力更具规模效应。礼来引入这两大技术平台的未来价值,在于加速生物制剂、肽类药物和下一代抗体药物的研发。
这三类药物的开发,本质上均属于设计全新的蛋白质。蛋白质分子量大、内部的序列结构错综复杂,任何微小的序列调整都可能改变其作为药物的疗效。尽管当下已有预测蛋白质结构的AI工具,能将预测单个蛋白质结构的时间压缩到数小时,但药物研发往往需要对成百上千个分子进行筛选,耗费的总时间依然漫长。
BioNeMo与Vera Rubin联用产生的规模效应由此显现,其内含的上千个GPU能够同时模拟上千个分子,并根据测试结果反复对分子进行优化、再测试、再优化。优化的维度不只是分子结构,还包括分子亲和力、功能、量产的可行性等。过去需要数月才能完成的流程,借助BioNeMo和Vera Rubin只需要数周甚至数天。
安进已经对此进行了验证。早在2023年,安进就借助经过预训练的BioNeMo平台,将5个候选分子筛选和优化的时间从3个月压缩到了数周。
对于礼来而言,内分泌代谢、免疫与炎症、肿瘤等都是未来重点押注的疾病领域,意味着生物制剂、抗体、多肽等药物类型将是开发重点。BioNeMo和Vera Rubin对大分子药物设计和优化的显著提速作用,将让礼来如虎添翼。
除了新药开发这样的“常规操作”,礼来还计划利用AI辅助扩大热销药品的产能,增强供应链稳定性,以更加直接的方式赋能商业增长。
例如,礼来利用前沿的数字孪生技术“建造”了一座虚拟工厂,对其进行压力测试,探索如何在保证生产安全性与药品质量的前提下,最大限度加速药物生产。
阿斯利康:AI联合基因组学,开发First-in-class自免疗法
对于AI制药,阿斯利康采取了相对稳健的战略。公司首席数据科学家Jim Weatherall曾对《金融时报》说,AI现在宣传得有些夸张了,阿斯利康应对的方法,就是更小心地将AI作为工具引入。
尽管如此,近两年,阿斯利康还是在药物筛选、靶点验证、生物标志物发现等领域都引入了AI。其中较有行业趋势性的交易是在2025年10月,阿斯利康宣布与Algen Biotechnologies签署合作,潜在交易总金额5.5亿美元,标志着AI辅助药物发现引入了基因组学。
Algen Biotechnologies萌芽于加州大学伯克利分校的一个实验室,创始团队包括多名AI与基因组学领域的专家,公司顾问是基因编辑领域的传奇人物——CRISPR技术发明者之一、诺贝尔奖得主Jennifer Doudna。
Algen Biotechnologies的核心技术平台是AlgenBrain,能够将深度学习与高通量功能基因组学相结合。这一平台的独特之处在于,它不只是一个预测工具,还能提升转化医学的效率。
当疾病发生和进展时,细胞的遗传物质RNA也会发生变化。AlgenBrain平台能够捕捉数十亿的RNA动态变化并进行分析,再利用CRISPR技术对单个细胞进行基因调控,不断测试某个基因变化与疾病之间的因果关系,描绘出疾病发生的机制,甚至识别出新的致病基因,进而更有针对性地找到新的治疗靶点。
这说明AlgenBrain是一种高效的AI药物开发工具,使得早期药物研发不再单纯依赖于动物实验,而是可以从一开始就基于人类疾病生物学进行开发,降低候选药物进入人体试验后失败的风险。
当前学界对免疫细胞的调控技术相对成熟,AlgenBrain平台也将免疫与炎症疾病作为主攻方向。对于阿斯利康而言,AlgenBrain平台基于疾病生物学的药物开发模式,有望帮助其在免疫与炎症领域发现全新靶点,开发出First-in-class药物,在该领域建立填补治疗空白,或在同一疾病上建立更具差异化优势的产品管线。
据弗若斯特沙利文预测,到2030年,全球自免性疾病药物市场规模将达1638亿美元。该领域目前仍有多种疾病病理机制尚不清楚,疗效与适应症拓展空间较大,这些都将成为阿斯利康在自免领域的突破口。
艾伯维:AI辅助改良致幻剂,开发Best-in-class精神病疗法
同样借助AI提升疾病领域地位的还有艾伯维,其自免王牌产品修美乐(阿达木单抗)专利已经到期,2025年Q3销量同比下降50%以上。在巩固自免领域地位的同时,艾伯维选择将神经科学作为新的增长发力点。
2024年5月,艾伯维宣布与Gilgamesh Pharmaceuticals签署合作与选择授权协议,共同基于Gilgamesh的技术平台开发下一代精神病药物,交易总价超20亿美元。
Gilgamesh是一家专注于神经科学领域的临床阶段药企,致力于针对精神疾病的根本性病因,开发快速起效、疗效持久的Best-in-class新型化学分子,改变当前精神疾病药物仅抑制症状、难以触及病因的现状。
Gilgamesh原本想要基于致幻剂的机制开发药物,但后来受到科学研究结果启发——致幻剂能够治疗精神疾病,是因为其能够进行神经重塑。这类能够增强神经可塑性的分子,被称为神经可塑性原(neuroplastogen)。基于此,Gilgamesh建立了专门的技术平台,寻找非致幻性的神经可塑性原,最大程度“去幻留效”,以提高该类药物的用药便利性和监管认可度。
作为这一药物开发模式的先行者,Gilgamesh的平台一大特点就在于融合了AI和机器学习算法,借此从多个维度对已知和新型的精神活性分子的生物活性进行标记和分类,从而提高临床转化效率。这些测量维度包括复杂的行为评估、高级电生理学,以及对一个分子神经可塑性的测量等。
基于神经可塑性原平台,Gilgamesh已经开发出两个临床阶段的新型抑郁症疗法——Bretisilocin(短效5-HT2A受体激动剂)和Blixeprodil(口服NMDA受体拮抗剂)。Bretisilocin IIa期临床结果积极,已授权给艾伯维。
神经科学产品已成为艾伯维重要的增长来源,占公司营收的比例仅次于其“王牌”领域自免。2025年前三季度,艾伯维神经科学产品累计录得78亿美元以上营收,全年营收有望突破100亿美元。在2025年Q2财报电话会上,艾伯维CEO Robert A.Michael更是放出豪言称,2026年要成为业内最大的神经科学公司。(相关阅读:CNS野心家艾伯维)
AI加持下,艾伯维正加速向宏伟目标驶去,并有望凭借Best-in-class疗法,引领下一波精神疾病治疗革命。
总结
头部药企对AI的部署各有侧重。阿斯利康和艾伯维正在利用AI驱动的技术平台革新药物开发模式,以期提升在特定疾病领域的地位。礼来则是将药物筛选和设计这一传统AI功能进行规模化放大,并利用AI全链条赋能研发、生产制造、配送供应等环节。
这也显示出,AI在制药领域的应用场景不断拓展,逐渐从助手向导师甚至是指挥官的角色转变。这场革命能否催生出更多突破式创新疗法,攻克更多精准治疗手段匮乏的疾病,值得长期关注。

 产业资讯
产业资讯
 新康界
新康界  2026-02-06
2026-02-06
 4
4

 产业资讯
产业资讯
 CPHI制药在线
CPHI制药在线  2026-02-06
2026-02-06
 3
3

 产业资讯
产业资讯
 同写意
同写意  2026-02-06
2026-02-06
 4
4